CHŁONIAKI INDOLENTNE: FL, MZL, MW
Chłoniaki, o których będziemy tu opowiadać, czyli chłoniak grudkowy, chłoniaki strefy brzeżnej i chłoniak limfoplazmocytowy/ makroglobulinemia Waldenströma to chłoniaki zaliczane do tak zwanych chłoniaków „indolentnych”, czyli charakteryzujących się powolnym przebiegiem klinicznym. To grupa chłoniaków, które wymagają okresowego leczenia przy nasileniu objawów. Wymagają one nadzoru odpowiedniego specjalisty: hematologa lub onkologa i leczenia dopiero wtedy, kiedy jest ono potrzebne.
- WSTĘP
- CHŁONIAK INDOLENTNY B-KOMÓRKOWY- CO TO OZNACZA?
- OBJAWY CHŁONIAKÓW INDOLENTNYCH B-komórkowych
- SKĄD WIADOMO, że to na pewno chłoniak indolentny B-komórkowy
- BADANIA DIAGNOSTYCZNE
- STRATEGIA WATCH & WAIT
- STADIUM ZAAWANSOWANIA KLINICZNEGO I CZYNNIKI RYZYKA
- KWALIFIKACJA DO LECZENIA
- LECZENIE CHŁONIAKA GRUDKOWEGO
- LECZENIE CHŁONIAKÓW STREFY BRZEŻNEJ
- LECZENIE MAKROGLOBULINEMII WALDENSTRÖMA
- OCENA ODPOWIEDZI NA LECZENIE
- PRAKTYCZNIE O LECZENIU
Chwila, w której dowiadujesz się o rozpoznaniu chłoniaka indolentnego czy makroglobulinemii Waldenströma (która także jest chłoniakiem i o której najprawdopodobniej nigdy wcześniej nie słyszałeś), jest na pewno bardzo trudnym momentem.
Pojawiają się obawy, niepewność, lęk, a dotychczasowe życie ulega zmianie. Nawet jeżeli nie ma wskazań do rozpoczęcia leczenia, a chorobę jedynie monitorujemy, zalecając okresową kontrolę i badania, niepokój pozostaje, a wraz z nim pytania, dlaczego nic nie robimy z Twoim chłoniakiem i pozwalamy mu tak po prostu sobie rosnąć. Przecież wszyscy wiedzą, że lepiej rozpoczynać leczenie jak najwcześniej, tymczasem my tego nie robimy. Do tego dochodzi jeszcze cała otoczka życia z „nieuleczalną” chorobą nowotworową, choć u znacznej części pacjentów chłoniaki opisane w tym poradniku nie skrócą długości życia. Większość chorych umrze „z” chłoniakiem, a nie „na” chłoniaka.
Należy tu z całą mocą podkreślić, że chłoniaki indolentne to choroby przewlekłe, takie jak nadciśnienie czy cukrzyca. Najczęściej wymagają jedynie okresowego leczenia.
W tym poradniku opowiemy Ci o tym, czym są chłoniaki, którym poświęcony jest ten poradnik, co oznaczają dla Ciebie – dla Twojego życia, zdrowia i planów na przyszłość.
CHŁONIAK INDOLENTNY B-KOMÓRKOWY-
CO TO OZNACZA?
Jak już wiesz, chłoniaki indolentne to grupa chłoniaków o małej dynamice klinicznej, które wymagają okresowego leczenia przy nasileniu objawów. Pomimo, iż jest to dość specjalistyczna wiedza, powinieneś wiedzieć, co oznaczają pewne sformułowania dotyczące poszczególnych chłoniaków opisanych w tym poradniku.
Nomenklatura chłoniaków podlega zmianom, w związku z czym może się zdarzyć, że będziemy nieco inaczej nazywać ten sam podtyp chłoniaka na przestrzeni lat, co nie wynika z naszego błędu, lecz ze zmieniającego się stanu wiedzy.
Nazewnictwo chłoniaków indolentnych B-komórkowych, wywodzących się z dojrzałych limfocytów B, uległo pewnym zmianom w najnowszej klasyfikacji World Health Organisation (WHO), 5. edycji. Podsumowaliśmy ją w tabeli, podając polskie nazwy, ich angielskie odpowiedniki i najczęściej używane skróty – po to, by każdy z Was mógł odnaleźć swoje rozpoznanie, niezależnie od sposobu, w jaki je przedstawiono na kartach wypisowych czy wyniku badania histopatologicznego.
Tu, może jedna dygresja – rozporządzenia o dokumentacji medycznej wymagają kodowania rozpoznań wg ICD10. To niedoskonałe narzędzie, zwłaszcza że z trudnych do odgadnięcia przyczyn w Polsce stosuje się od lat starą wersję ICD10 z czasów, w których klasyfikacja chłoniaków była inna. Stąd jako rozpoznania główne w kartach wypisowych mogą znaleźć się wprowadzające w błąd nazwy jednostek, których już nie ma w obecnie stosowanych klasyfikacjach chłoniaków. O ile chłoniak grudkowy (C82, Chłoniak nieziarniczy guzkowy [grudkowy], C82, C82.0, C82.1, C82.2, C82.7, C82.9) i Makroglobulinemia Waldenströma (C88.0) mają przynajmniej podobne nazwy, chłoniaki strefy brzeżnej są kodowane jako C85 (inne i nieokreślone postacie chłoniaka nieziarniczego) lub wręcz C85.1 (Chłoniak z komórek B, nieokreślony). Nie oznacza to w żadnym przypadku, że Twoje rozpoznanie jest nieustalone, chłoniak nieznany, a lekarze nie wiedzą, co leczą.
EPIDEMIOLOGIA, czyli jak często zdarza się choroba?
Monoterapia z rytuksymabem, którą czasem pro-ponuje się pacjentom z małą masą guza, to zwy-kle 4 dawki podawane w odstępie tygodnia, z na-stępowym leczeniem podtrzymującym (dawki le-ku co 2-3 miesiące w kolejnych 2 latach).
Chłoniak grudkowy jest drugim najczęstszym chłoniakiem indolentnym, po chłoniaku z małych limfocytów B/przewlekłej białaczce limfocytowej (SLL/CLL). W Stanach Zjednoczonych Ameryki Północnej i Europie Zachodniej stanowi około 20-30% wszystkich rozpoznań chłoniaków, natomiast w Europie Środkowo-Wschodniej i Azji z niewyjaśnionych przyczyn występuje znacz-nie rzadziej (7-10%). W Polsce mieliśmy w 2021 roku 526 nowych przypadków, czyli ponad dwukrotnie więcej niż 20 lat wcześniej, co odzwierciedla sta-rzenie się populacji (FL jest częstszy po 60 roku życia), lepszą diagnostykę i – prawdopodobnie – zacieranie się różnic w stylu i standardzie życia w po-równaniu z Europą Zachodnią.
Chłoniaki strefy brzeżnej są trzecim co do częstości podtypem chłoniaków indolentnych. Chorują głównie pacjenci starsi, zachorowalność wzrasta wraz ze wzrastającym wiekiem. Ogółem częściej chorują mężczyźni, niemniej chłoniaki strefy brzeżnej ślinianek i tarczycy częściej występują u kobiet.
Makroglobulinemia Waldenströma jest najrzadszym z omawianych w tym poradniku chłoniaków. W Europie rozpoznaje się zaledwie 7,3 przypadków/ 1 mln mężczyzn i 4,2 przypadków/1 mln kobiet. Zachorowalność na makroglobulinemię Waldenströma wzrasta wraz z wiekiem. Większość pacjentów w momencie rozpoznania ma >70 lat.
JAK ROZWIJA SIĘ CHŁONIAK INDOLENTNY?
Monoterapia z rytuksymabem, którą czasem pro-ponuje się pacjentom z małą masą guza, to zwy-kle 4 dawki podawane w odstępie tygodnia, z na-stępowym leczeniem podtrzymującym (dawki le-ku co 2-3 miesiące w kolejnych 2 latach).
W chłoniaku grudkowym dochodzi do transformacji nowotworowej tzw. lim-focyta B grudki chłonnej. Jest to proces wtórny do szeregu nieprawidłowości genetycznych, w tym takich, które doprowadzają do nadekspresji białka BCL2, chroniącego komórki nowotworowe przed apoptozą (umieraniem), jak również takich genów jak: KMT2D, CREBBP, EZH2. W wyniku tych nieprawidłowości nowotworowe limfocyty zostają „uwięzione” w grudkach chłonnych, gdzie – stale pobudzane do podziałów – w końcu podlegają transformacji nowotworowej. Podobny mechanizm obserwujemy po usunięciu migdałków: ich funkcję przejmują okoliczne węzły chłonne tzw. pierścienia Waldeyera, a ich nadmierne, powtarzające się pobudzenie wiąże się po latach z większą częstością chłoniaków.
W przypadku chłoniaków strefy brzeżnej stwierdza się związek przyczynowo skutkowy z przewlekłym procesem zapalnym. Takim procesem może być długo trwające zapalenie błony śluzowej żołądka bakteriami Helicobacter pylori, infekcje płucne Achromobacter xylosoxidans, zapalenie spojówek wywołane przez Chlamydophila psittaci, infekcje skórne Borrelia burgdoferi czy też wirusowe zapalenie wątroby wywołane wirusem zapalenia wątroby typu C (HCV).
Drugą sytuacją, w której mamy do czynienia z długotrwałą aktywacją układu odpornościowego, są choroby immunizacyjne, takie jak choroba Hashimoto (autoimmunologiczne zapalenie tarczycy) czy zespół Sjögrena (dotyczący głównie ślinianek). Czynnikami, które sprzyjają wystąpieniu chłoniaków strefy brzeżnej, są również inne choroby autoimmunologiczne (np. toczeń rumieniowaty układowy) czy obecność określonych cech genetycznych dotyczą-cych tzw. układu HLA.
U większości pacjentów chorych na makroglobulinemię Waldenströma stwierdza się obecność somatycznej (nabytej w czasie życia człowieka, nie wrodzonej) mutacji MYD88. Nie jest ona jednak patognomoniczna dla tego chłoniaka – może występować również w nielicznych przypadków chłoniaków strefy brzeżnej.
CZY MOI BLISCY SĄ TAKŻE NARAŻENI NA CHŁONIAKA?
Bardzo często pacjenci zastanawiają się, czy ich bliscy lub dzieci także są narażeni na wystąpienie chłoniaka. Poza badaniami naukowymi nie ma testów, które potrafiłyby taką skłonność wykryć, a zatem członkowie rodzin chorego na chłoniaka nie wymagają żadnych badań profilaktycznych.
Nasza wiedza ulega jednak gwałtownemu rozwojowi, stąd o ile mutacje genów predysponujących do chłoniaka (germinalne, czyli wrodzone) zostaną wykryte, lekarz prowadzący poinformuje Cię o tym.
Pewnego komentarza wymaga sytuacja, gdy w danej rodzinie zdarza się jednak częstsze występowanie chłoniaków - przy obecnym stanie wiedzy nie da się tego najczęściej tłumaczyć jakąś określoną, możliwą do zdefiniowania i znalezienia predyspozycją genetyczną. Pewną rolę odgrywają tu - podobne u członków rodziny - czynniki środowiskowe, zwyczaje dietetyczne i tryb życia.
I na koniec trochę statystyki: w Polsce zapadalność na chłoniaka grudkowego to 1.3 osób/100 000 osób rocznie. Nawet gdyby przyjąć, znacznie na wyrost, że rozpoznanie chłoniaka zwiększa 2-krotnie ryzyko zachorowania krewnych, to nadal mówimy o 2,6 zdarzeniach na 100 000 osób rocznie, czyli o ryzyku rzędu 0,0026%.
OBJAWY CHŁONIAKÓW INDOLENTNYCH B-komórkowych
Jak już wcześniej wspomniano, pomimo pojawienia się pojedynczych objawów, nie zawsze podejmujemy leczenie.
Natomiast należy objawy znać i obserwować, a w razie ich nasilenia lub pojawienia nowych, poinformować lekarza prowadzącego.
Monoterapia z rytuksymabem, którą czasem pro-ponuje się pacjentom z małą masą guza, to zwy-kle 4 dawki podawane w odstępie tygodnia, z na-stępowym leczeniem podtrzymującym (dawki le-ku co 2-3 miesiące w kolejnych 2 latach).
Wielu pacjentów chorych na chłoniaka grudkowego może początkowo nie zauważać objawów choroby, a jedyną niedogodnością mogą być częstsze lub przewlekające się infekcje.
POWIĘKSZENIE WĘZŁÓW CHŁONNYCH
Najbardziej typowym objawem klinicznym jest limfadenopatia, czyli powiększenie węzłów chłonnych. Powiększone mogą być zarówno węzły chłonne tzw. obwodowe, które możemy zidentyfikować w badaniu przedmiotowym (np. szyjne, pachowe, pachwinowe) jak i węzły chłonne znajdujące się wewnątrz, tj. w śródpiersiu czy jamie brzusznej, które najczęściej są widoczne tylko w wykonanych badaniach obrazowych.
W przypadku powiększonych węzłów chłonnych obwodowych możesz sam je wyczuć jako guzki albo wręcz duże guzy w typowych, wspomnianych wcześniej lokalizacjach.
W przypadku lokalizacji wewnątrz jamy brzusznej mogą dominować dolegliwości bólowe brzucha czy zaburzenia czynnościowe ze strony przewodu pokarmowego. W przypadku lokalizacji w obrębie klatki piersiowej – przewlekły kaszel czy duszność przy wysiłku. Węzły zajęte przez chłoniaka nie zwracają na siebie początkowo uwagi – nie są tkliwe, bolesne, nie towarzyszą im objawy lokalnego stanu zapalnego, można je z łatwością przesuwać względem okolicznych tkanek. Węzły chłonne u pacjentów chorych na chłoniaka grudkowego mogą powoli powiększać się niezauważone przez wiele lat przed postawieniem rozpoznania.
NIE ZAWSZE POWIĘKSZENIE WĘZŁÓW OZNACZA PROGRESJĘ CHŁONIAKA. Komórki chłoniaka grudkowego wywodzą się z dojrzałych limfocytów, które mogą zachować część funkcji komórek prawidłowych. Prawidłowe węzły chłonne, o średnicy paru milimetrów, powiększają się w odczynie na każdy proces zapalny. W przypadku klasycznej anginy paciorkowcowej (zapalenia migdałków) można z łatwością wybadać odczynowe węzły o średnicy 10-15 mm, tkliwe przy ucisku, same z siebie bolesne, zaczerwienione. Jeżeli anginę ma chory na chłoniaka, przed infekcją z węzłami o średnicy 1-2 cm, mogą się one okresowo powiększyć do 3-5 cm, wzbudzając obawę ze względu na dynamikę procesu. Zwykle wracają do swych poprzednich rozmiarów po zakończeniu infekcji, co bynajmniej nie oznacza cofnięcia się procesu nowotworowego, a jedynie ustąpienie odczynu.
OBJAWY TYPU B gorączka, poty, utrata masy ciała
U części chorych mogą występować też tzw. objawy B. W znaczeniu hematoonkologicznym oznacza to, że mogą pojawić się objawy takie jak gorączka, nocne poty lub utrata masy ciała. Objawy te muszą spełniać określone warunki. Po pierwsze nie mogą być spowodowane inną zidentyfikowaną przyczyną, po drugie, w przypadku utraty masy ciała, nie mogą wynikać z celowego działania zmierzającego do redukcji masy ciała. I tak gorączka (nie stan podgorączkowy!) musi trwać co naj-mniej 2 tygodnie, podobnie jak nocne poty.
W przypadku nocnych potów mówimy o sytuacji, kiedy na skutek zlewnego pocenia musisz zmieniać bieliznę nocną, bieliznę pościelową, czasami zaś, by zapobiegać zmianie bielizny pościelowej, używasz w domu łatwo wymienialnych ręczników. Co do utraty masy ciała, musi ona wynosić co najmniej 10% masy wyjściowej i dochodzi do niej w czasie nie dłuższym niż 6 miesięcy.
INNE OBJAWY ZWIĄZANE Z LOKALIZACJĄ
Oczywiście w przebiegu chłoniaka grudkowego możliwe jest występowanie innych objawów, które wynikają z różnych lokalizacji chłoniaka i mogą wiązać się z uciskiem na inne narządy/struktury lub z wysiękiem tj. płynem gromadzącym się np. w jamie opłucnej czy otrzewnowej.
Objawy kliniczne chłoniaków strefy brzeżnej są bardzo różnorodne i zależą od określonego podtypu chłoniaka i konkretnej lokalizacji anatomicznej. Najbardziej zróżnicowane są one w przypadku pozawęzłowych chłoniaków strefy brzeżnej (chłoniaki MALT), gdy nacieki chłoniaka dotyczą błon śluzowych. Poniżej przedstawiamy przykłady tych objawów, posegregowane w zależności od lokalizacji chłoniaka. WAŻNE! Poniższe okolice mogą być zajmowane także w przebiegu innych chłoniaków, tu opisaliśmy wyłącznie ich zajęcie w przebiegu chłoniaka strefy brzeżnej.
CHŁONIAK ŻOŁĄDKA
Ból w nadbrzuszu, dolegliwości żołądkowe, utrata masy ciała, objawy krwawienia z przewodu pokarmowego – zarówno przewlekłego (niedokrwistość z niedoboru żelaza objawiająca się osłabieniem, pogorszeniem tolerancji wysiłku, nadmierną sennością, bladością powłok ciała), jak i – znacznie rzadziej – ostrego (krwiste wymioty, czarne/ smoliste stolce).
CHŁONIAK PŁUCA
Kaszel, duszność, ból w klatce piersiowej. Najczęściej jednak objawy chłoniaka płuca nakładają się na obraz infekcji, często przewlekających się lub nawrotowych, a możliwość jego rozpoznania zaczynamy brać pod uwagę, analizując badania obrazowe (badanie radiologiczne klatki piersiowej lub tomografię komputerową).
CHŁONIAK ŚLINIANKI
Powoli rosnący guzek w obrębie ślinianki, część chorych może odczuwać nadmierną „suchość” jamy ustnej.
CHŁONIAK TARCZYCY
Powoli rosnący guzek w obrębie tarczycy.
CHŁONIAK JELITA CIENKIEGO
Biegunka, ból brzucha, chudnięcie/niedobory pokarmowe – będące wynikiem zaburzeń wchłaniania w jelicie.
CHŁONIAK JELITA CIENKIEGO
Biegunka, ból brzucha, chudnięcie/niedobory pokarmowe – będące wynikiem zaburzeń wchłaniania w jelicie.
CHŁONIAK JELITA GRUBEGO
Krwawienie z przewodu pokarmowego (np. krew na stolcu, obecność krwi w kale, niedokrwistość z niedoboru żelaza), wgłobienie lub niedrożność przewodu pokarmowego – objawiające się bardzo silnymi dolegliwościami bólowymi brzucha, twardym, napiętym brzuchem, nieodchodzeniem gazów. Może się zdarzyć, że chłoniak jelita grubego zostanie wykryty przypadkowo w badaniu endoskopowym, czyli w kolonoskopii albo w badaniu tomografii komputerowej.
CHŁONIAK OPONY TWARDEJ
Możliwe jest występowanie różnych objawów neurologicznych, bólów głowy, porażeń nerwów czaszkowych.
CHŁONIAK SKÓRY
Czerwone lub fioletowe grudki, zmiany naciekowe lub guzki, zlokalizowane najczęściej na tułowiu lub kończynach górnych.
SPLENOMEGALIA
W przypadku znacznego powiększenia śledziony możesz samodzielnie wyczuć nieprawidłową strukturę pod lewym łukiem żebrowym. Ze splenomegalią wiążą się takie dolegliwości jak: dyskomfort w lewym podżebrzu, wczesne uczucie sytości, tj. uczucie sytości pojawiające się po niewielkiej ilości posiłku, utrata masy ciała.
Splenomegalii mogą towarzyszyć objawy niedokrwistości (osłabienie, pogorszenie tolerancji wysiłku, nadmierna senność, ból głowy, ból w klatce piersiowej) lub małopłytkowości, czyli obniżonej liczby płytek krwi (drobne punkcikowate wybroczyny na skórze, wybroczyny na śluzówkach jamy ustnej, krwawienia z nosa, dziąseł i innych błon śluzowych).
Należy tu wspomnieć o podtorebkowym pęknięciu śledziony – bardzo rzadkim, ale potencjalnie niebezpiecznym następstwie urazów. W przypadku znacznie powiększonej śledziony uraz może być błahy, np. wywołany prawidłowym działaniem pasów bezpieczeństwa w samochodzie przy nagłym hamowaniu. Pojawia się wtedy silny ból w lewym nadbrzuszu, którego nie wolno bagatelizować. Zachowując spokój, należy pilnie wezwać pogotowie, by – unikając nagłych ruchów – w komfortowych warunkach zostać przewiezionym na ostry dyżur chirurgiczny. Rokowanie jest dobre, o ile w czasie transportu nie dojdzie do przerwania torebki śledziony w naturalny sposób hamującej krwawienie (co zapobiega nagłej masywnej utracie krwi i wstrząsowi hipowolemicznemu/pokrwotocznemu).
OBJAWY TYPU B
Objawy B bardzo rzadko występują w chłoniakach strefy brzeżnej. Znacznie częściej mogą się jednak pojawiać, kiedy dochodzi do transformacji chłoniaków strefy brzeżnej do chłoniaków o przebiegu agresywnym. Dlatego zawsze, jeżeli wystąpią u Ciebie takie objawy, a masz rozpoznanego już chłoniaka strefy brzeżnej, powinieneś pilnie skontaktować z prowadzącym hematologiem/onkologiem.
OBJAWY WYNIKAJĄCE Z OBECNOŚCI BIAŁKA MONOKLONALNEGO.
U części pacjentów mogą pojawić się dodatkowe powikłania wynikające z obecności białka mo-noklonalnego, czyli przeciwciał produkowanych przez nowotwór. Są to:
- niedokrwistość autoimmunohemolityczna – objawiająca się niedokrwistością, żółtaczką o różnym nasileniu, ciemnym zabarwieniem moczu, czasami gorączką, bólem w okolicy lędźwiowej,
- małopłytkowość immunizacyjna – może przebiegać bezobjawowo lub z objawami skazy krwotocznej tzn. wybroczynami
na skórze i śluzówkach, krwawymi podbiegnięciami na skórze, krwawieniami z nosa, dziąseł, dróg rodnych i innych lokalizacji, - choroba zimnych aglutynin
- nabyty zespół von Willebranda,
- mieszana krioglobulinemia,
- nabyty niedobór inhibitora C1-esterazy.
O objawach tych schorzeń przeczytasz szerzej przy makroglobulinemii Waldenströma, ponieważ w jej przypadku występują one częściej.
Objawy makroglobulinemii Waldenströma są dość różnorodne. Podobnie, jak w innych chłoniakach, dochodzi do nacieczenia szpiku, węzłów chłonnych czy śledziony. Najczęściej pierwszym objawem jest przewlekłe zmęczenie wynikające z niedokrwistości. Dodatkowo komórki chłoniaka wytwarzają białko monoklonalne klasy IgM, którego nadmiar odpowiada za zespół charakterystycznych objawów omówionych poniżej bardziej szczegółowo.
OBWODOWA NEUROPATIA
Występuje u około 20% pacjentów, a główne objawy to: parestezje (mrowienia, drętwienia rąk i stóp), ubytki czucia, dolegliwości bólowe, zaburzenia rów-nowagi, ataksja (zaburzenie koordynacji ruchowej, utrudniające płynne i dokładne wykonywanie ru-chów) czy atrofia mięśni kończyn w zaawansowanych stadiach choroby.
ZESPÓŁ NADLEPKOŚCI
To zespół objawów spowodowanych zwiększeniem lepkości krwi, bezpośrednio związany z ilością wytwarzanych monoklonalnych immunoglobulin klasy M (IgM). Nadmierna lepkość krwi objawiać się może krwawieniem z błon śluzowych, zaburzeniami wzroku spowodowanymi retinopatią i objawami neurologicznymi, takimi jak bóle głowy, zawroty głowy, drgawki czy śpiączka. Prawdopodobieństwo wystąpienia zespołu nadlepkości wzrasta, jeśli stężenie IgM przekracza 40 g/L (4 g/dL). W takich przypadkach, jest to wskazanie do rozpoczęcia leczenia MW (a w razie szczególnie wysokich wartości rozważenia plazmaferezy.
CHOROBA ZIMNYCH AGLUTYNIN
Występuje u <10% pacjentów. Jej objawy pojawiają się po ekspozycji na zimno i są związane z hemolizą, do której dochodzi w naczyniach krwionośnych. Może wystąpić osłabienie, gorączka, zażółcenie powłok ciała i spojówek, ciemny mocz, czasami ból w okolicy lędźwiowej. Dodatkowo, w części przypadków, obserwuje się akrocyjanozę (tj. purpurowe zabarwienie koniuszka nosa i uszu, dalszych części palców i paluchów), siność siatkowatą (czerwononiebieskie, siateczkowate plamy na skórze), ból i dyskomfort przy połykaniu zimnych pokarmów.
KRIOGLOBUILINEMIA
Występuje u ok. 1% pacjentów. Jej główne objawy to: plamica (skaza krwotoczna), owrzodzenia skóry, zapalenie naczyń, zapalenia stawów, obwodowa neuropatia z objawami jak wymieniono wcześniej, krwiomocz (czerwony mocz) i kłębuszkowe zapalenie nerek (obrzęki, pienienie się moczu, przesięki w jamach ciała np. w otrzewnej, opłucnej, osierdziu, nadciśnienie tętnicze, niedożywienie, wyniszczenie).
NABYTY ZESPÓŁ VON WILLEBRANDA
Objawia się powikłaniami krwotocznymi.
AMYLOIDOZA
Jest to odkładanie się złogów amyloidu mogących prowadzić do nieodwracalnego uszkodzenia różnych narządów (np. nerek, serca), zaburzenia wchłaniania w przewodzie pokarmowym, krwiaków powiek.
POZOSTAŁE OBJAWY
Ponadto pacjenci z makroglubulinemią Waldenströma mogą doświadczać: zapalenia związanego z obecnością kompleksów immunologicznych czy zespołu Schnitzlera (wysypka, pokrzywka).
W bardzo rzadkich przypadkach makroglobulinemii Waldenströma obserwuje się nacieki komórek chłoniakowych w płucach (rozlane lub guzkowe nacieki, płyn w jamie opłucnowej, kaszel, duszność, bóle w klatce piersiowej), jelitach (zespół złego wchłaniania, biegunka, krwawienia) czy w ośrodkowym układzie nerwowym pod postacią zespołu Bing-Neela. W przypadku zespołu Bing-Neela najczęściej występują zaburzenia równo-wagi i zaburzenia chodu. Zespół ten charakteryzuje się ponadto porażeniami nerwów czaszkowych, zaburzeniami funkcji poznawczych, bólami i zawrotami głowy; w bardziej zaawansowanych postaciach splątaniem, ataksją i po-dwójnym widzeniem, aż do wystąpienia śpiączki włącznie.
SKĄD WIADOMO,
że to na pewno chłoniak indolentny
B-komórkowy
Podstawowym i pierwszym badaniem jest pobranie węzła chłonnego lub innej podejrzanej o zmiany nowotworowe tkanki. Dla szybkiej i prawidłowej diagnostyki niezmiernie ważne jest, by pobrać cały węzeł lub reprezentatywny fragment podejrzanej tkanki. Dodatkowo, w przypadku niektórych chłoniaków, istotne znaczenie ma badanie immunofenotypu komórek (krwi obwodowej, aspiratu szpiku lub węzła chłonnego) metodą cytometrii przepływowej.
Pobrana tkanka zostaje odpowiednio utrwalona i opracowana w pracowni histopatologicznej, gdzie po szeregu badań dodatkowych określa się, czy i jaki nowotwór się w niej znajduje. Ten proces może trwać nawet kilka tygodni.
Choć słysząc o podejrzeniu chłoniaka, chcielibyśmy, aby ostateczna diagnoza padła jak najszybciej, koniecznie należy uzbroić się w cierpliwość. Nawet przy szybkim terminie pobrania materiału do badania trzeba poczekać na dokładną ocenę histologiczną, a w części przypadków na uzupełnienie klasycznego badania histopatologicznego o badania genetyczne. Możliwe, a nawet prawdopodobne jest, że pobrane wycinki będą wstępnie ocenione w ogólnym zakładzie patologii, a następnie ponownie w ośrodku specjalistycznym, zajmującym się diagnostyką chłoniaków.
W badaniu histopatologicznym potwierdzającym diagnozę oceniany jest sam charakter nacieku (grudkowy vs rozlany), morfologia komórek nowotworowych oraz dodatkowe barwienia immunohistochemiczne pozwalające na opisanie ekspresji antygenów znajdujących się na powierzchni komórki i niektórych białek wewnątrzkomórkowych. Wszystko razem, uzupełnione
w wybranych przypadkach o badania cytogenetyczne i badania wykorzystujące metody biologii molekularnej, pozwala określić z jaką chorobą mamy do czynienia.
Należy jednak pamiętać, że powyżej opisano tylko niektóre z wykonywanych badań, ich interpretację należy zostawić prowadzącemu leczenie specjaliście.
Monoterapia z rytuksymabem, którą czasem pro-ponuje się pacjentom z małą masą guza, to zwy-kle 4 dawki podawane w odstępie tygodnia, z na-stępowym leczeniem podtrzymującym (dawki le-ku co 2-3 miesiące w kolejnych 2 latach).
Chłoniak grudkowy zbudowany jest z dwóch rodzajów komórek, tzw. centrocytów (niedzielących się limfocytów B z rozszczepionym jądrem) i centroblastów (szybko dzielących się limfocytów B o nierozszczepionym jądrze).
Komórki te charakteryzują się ekspresją powierzchniowych immunoglobulin, ponadto wykazują ekspresję antygenów CD19, CD20, CD22, CD79a. Z reguły są dodatnie w kierunku BCL2, BCL6 i CD10, ujemne natomiast w kierunku CD5 i CD43. W większości pracowni oznacza się również wskaźnik proliferacji Ki-67 (odzwierciedlający szybkość podziałów komórkowych – niską w razie wartości 5-10%, wysoką w przypadku wartości powyżej 50%).
W przypadku klasycznych chłoniaków grudkowych stwierdza się obecność translokacji t(14;18), która skutkuje nadmierną ekspresją białka BCL-2 uczestniczącego w blokowaniu apoptozy, czyli kontrolowanej, zaprogramowanej śmierci komórki. Oznacza to, że komórki chłoniaka grudkowego stają się oporne na umieranie. W zależności od liczby centroblastów chłoniak grudkowy opisuje się jako FL G1-G2 (mniej niż 15 szybko dzielących się komórek w polu widzenia) czy FLG3. Jeżeli naciek chłoniaka składa się z samych centroblastów (FL G3b), odpowiada to chorobie bliskiej transformacji do chłoniaka agresywnego – takie przypadki leczymy już jak chłoniaka rozlanego z dużych limfocytów B (DLBCL – diffuse large B cel lymphoma).
Chłoniaki strefy brzeżnej zbudowane są z małych dojrzałych nowotworowych limfocytów B, które typowo nie wykazują ekspresji CD5 i CD10. Często stwierdza się tzw. różnicowanie plazmatycznokomórkowe, jak również obecność reaktywnych grudek chłonnych. W przypadku śledzionowego chłoniaka strefy brzeżnej w większości przypadków wykonamy biopsję aspiracyjną, trepanobiopsję szpiku i pobranie krwi obwodowej. W badaniu szpiku ocenie zostanie poddany naciek limfocytami chłoniaka, zaś we krwi obwodowej zostanie oceniona obecność charakterystycznych komórek, ocenianych mikroskopowo i w cytometrze przepływowym. Cytometria przepływowa jest metodą, która pozwala – podobnie jak immunohistochemia – na ocenę obecności określonych antygenów, takich jak wspomniane już powyżej CD20, CD5 itd., na komórkach chłoniaka zawieszonych w płynie (krwi obwodowej, aspiracie szpiku kostnego lub aspiracie węzła chłonnego). Jej dodatkową zaletą jest szybkość oceny – wynik można uzyskać jeszcze tego samego dnia.
W przypadku makroglobulinemii Waldenströma w biopsji aspiracyjnej i trepanobiopsji szpiku stwierdza się obecność komórek LPL, czyli małych, pleomorficznych limfocytów B z limfoplazmocytowym/plazmatycznym różnicowaniem. Często stwierdza się zwiększony odsetek komórek tucznych, zlokalizowanych zwykle wokół nacieków z limfocytów. Na powierzchni komórek LPL obserwuje się ekspresję sIgM, CD19, CD20, CD79a (na limfocytach), CD38, (na komórkach plazmatycznych); w części przypadków (do 20%) stwierdza się obecność CD5, CD10 lub CD23. Typowo komórki LPL nie wykazują ekspresji CD3 i CD103.
W diagnostyce makroglobulinemii Waldenströma rekomendowana jest ocena obecności mutacji MYD88, która występują prawie u wszystkich pacjentów. U pacjentów kwalifikowanych do leczenia rekomenduje się również ocenę obecności mutacji CXCR4. Badanie tej mutacji jest jednak trudne technicznie i nie zawsze możliwe do wykonania poza ośrodkami specjalizującymi się w leczeniu chłoniaków.
Rekomendacje międzynarodowe wskazują również na konieczność wykonywania badania fluorescencyjnej hybrydyzacji in situ (FISH) w celu oceny chromosomów 6q i 17p, jak również badania PCR w kierunku mutacji genu TP53. Mutacje genu TP53 wiążą się ze złym rokowaniem w wielu nowotworach, w tym przewlekłej białaczce limfocytowej, czy chłoniaku z komórek płaszcza. Również w odniesieniu do makroglobulinemii Waldenströma obserwuje się gorsze rokowanie pacjentów ze zmutowanym genem TP53. Ocena tego genu na chwilę obecną nie wpływa bezpośrednio na wybór określonego sposobu postępowania terapeutycznego, niemniej jednak w oparciu o doświadczenie z innych nowotworów limfoidalnych, należy oczekiwać, że ulegnie to zmianie. Badania genetyczne są dostępne tylko w wyspecjalizowanych ośrodkach.
KOMPLETNE ROZPOZNANIE
Jeżeli otrzymasz wynik, w którym zamiast szczegółów napisano: „obraz może odpowiadać chłoniakowi „X” - wskazana konsultacja w ośrodku specjalizującym się w leczeniu chłoniaków”, należy - przed udaniem się do ośrodka specjalistycznego - wypożyczyć preparaty („bloczki parafinowe”). To utrwalone tkanki pobrane w czasie badania histopatologicznego, zatopione w parafinie lub żywicy - można je bezpiecznie przechowywać i przewozić w temperaturze pokojowej.
BADANIA DIAGNOSTYCZNE
Po ustaleniu rozpoznania chłoniaka konieczne jest wykonanie szeregu badań, które mają za zadanie ustalić stadium jego zaawansowania, jak również pomogą odpowiedzieć na pytanie, czy konieczne jest rozpoczynanie leczenia, czy też możesz być poddany jedynie obserwacji - strategia W&W (watch&wait).
Pamiętaj, że będą Ci zlecone WYBRANE badania opisane w tym rozdziale i każdy pacjent może otrzymać inny, indywidualnie dobrany schemat badań.
Monoterapia z rytuksymabem, którą czasem pro-ponuje się pacjentom z małą masą guza, to zwy-kle 4 dawki podawane w odstępie tygodnia, z na-stępowym leczeniem podtrzymującym (dawki le-ku co 2-3 miesiące w kolejnych 2 latach).
Badanie PET-TK to technika badania obrazowego łącząca tomografię z badaniem czynnościowym. Dzięki użyciu glukozy znakowanej izotopem uzyskujemy informację, czy w takim powiększonym węźle chłonnym lub innym zajętym narządzie widoczna jest aktywność nowotworu.
Wykorzystuje się fakt, że komórki nowotworowe są stosunkowo aktywne, stąd potrzebują więcej glukozy. „Zjadają ją, następnie trawią”, a pozostały w ich wnętrzu izotop wskazuje, gdzie są ich największe skupiska. Im więcej izotopu w danej okolicy, tym silniejszy sygnał i wyższy tzw. SUV (jeden z parametrów opisywanych w badaniu PET-TK). Podobnie dzieje się w przypadku reaktywnego pobudzenia komórek układu immunologicznego, stąd przed badaniem PET-TK należy upewnić się, czy nie mamy aktywnej infekcji (węzłów zmienionych odczynowo nie można odróżnić tą metodą od tych powiększonych z powodu chłoniaka).
Badanie PET-TK wykonuje się u pacjentów chorych na chłoniaki grudkowe. Czas wykonywania badań kontrolnych, oceniających skuteczność leczenia, zależy od sposobu leczenia i będzie dobrany odpowiednio przez Twojego lekarza prowadzącego. Zasadniczo badanie wykonuje się przy kwalifikacji do leczenia i po zakończonym leczeniu, a w wybranych przypadkach również po 2-gim cyklu w celu wczesnej oceny odpowiedzi na leczenie. Uzyskaną odpowiedź podaje się w stopniach Deauville, zgodnie z międzynarodowym systemem. Wartości w skali Deauville 1-3 świadczą o zadowalającej odpowiedzi metabolicznej, 4-5 oznaczają zwykle jedynie częściową odpowiedź lub wręcz progresję choroby.
W pełni wiarygodny wynik badania PET-TK można uzyskać w nie mniej niż 6 tygodni po podaniu ostatniego cyklu immunochemioterapii, wcześniej można się spodziewać wyników fałszywie ujemnych (komórki nowotworowe zachowują się „jak mysz pod łapą kota”, udając martwe, nieaktywne).
W przypadku radioterapii po leczeniu może utrzymywać się stan zapalny, który początkowo może dawać wynik fałszywie dodatni. Z tego względu wiarygodne wyniki są nie wcześniej niż w 3 miesiące po zakończeniu napromieniowania. Badanie PET-TK jest podstawą oceny stadium zaawansowania klinicznego wg. tzw. klasyfikacji Lugano (modyfikacji wcześniej stosowanej klasyfikacji z Ann Arbor). Na tej podstawie podejmuje się dalsze decyzje terapeutyczne. Dodatkowo u chorych na FL badanie PET-TK pozwala na potwierdzenie, czy wycinki pobrano z miejsca reprezentatywnego dla całej choroby – jeżeli jedna z lokalizacji wykazuje się asynchronicznym pobudzeniem, czyli jest o wyraźnie większej aktywności od pozostałych, wymaga to dodatkowej weryfikacji histopatologicznej, by wykluczyć możliwość transformacji do chłoniaka agresywnego.
Zastosowanie badania PET-TK w chłoniakach strefy brzeżnej jest obecnie przedmiotem badań.
U części pacjentów może być stosowane do oceny zaawansowania choroby i odpowiedzi na leczenie. Dużym wyzwaniem w prawidłowej ocenie badania PET-TK jest fakt, że część chłoniaków powstaje na podłożu przewlekłego procesu zapalnego – np. chłoniak żołądka u pacjenta z przewlekłym zapaleniem błony śluzowej żołądka. W tych przypadkach „świecenie” chłoniaka może nie różnić się od świecenia zmienionego zapalnie żołądka.
W diagnostyce makroglobulinemii Waldenströma nie wykonuje się badania PET-TK.
CO ROBIĆ W SYTUACJI INFEKCJI?
Każda infekcja utrudnia lub wręcz uniemożliwia interpretację badania PET-TK. Na pewno należy przełożyć termin badania, gdy wykonujemy je po zakończeniu terapii, dla potwierdzenia całkowitej odpowiedzi na leczenie. U chorych z infekcją wynik PET-TK może być fałszywie dodatni, tzn. błędnie sugerować brak remisji i potrzebę dalszego leczenia. Decyzje o przełożeniu terminu badania są mniej jednoznaczne w pozostałych przypadkach i muszą być podjęte przez lekarza prowadzącego.
ODWOŁAJ BADANIE, JEŚLI NIE MOŻESZ DOTRZEĆ
Każda infekcja utrudnia lub wręcz uniemożliwia interpretację badania PET-TK. Na pewno należy przełożyć termin badania, gdy wykonujemy je po zakończeniu terapii, dla potwierdzenia całkowitej odpowiedzi na leczenie. U chorych z infekcją wynik PET-TK może być fałszywie dodatni, tzn. błędnie sugerować brak remisji i potrzebę dalszego leczenia. Decyzje o przełożeniu terminu badania są mniej jednoznaczne w pozostałych przypadkach i muszą być podjęte przez lekarza prowadzącego.
NIE JEDZ, ALE PIJ WODĘ
W dniu badania należy bezwzględnie powstrzymać się od zjedzenia czegokolwiek i wypicia płynów zawierających jakiekolwiek kalorie. Tak, by podana glukoza znakowana izotopem była dla komórek nowotworowych pierwszą „dawką kalorii” w tym dniu. Należy natomiast zadbać o dobre nawodnienie (co najmniej 1-1,5 litra nie-gazowanej wody wypitej przed badaniem oraz dalszy litr wypity w trakcie badania). Jeżeli masz cukrzycę, nietolerancję glukozy lub przyjmujesz leki przeciwcukrzycowe, koniecznie poinformuj o tym pracownię PET-TK – zostaną wydane Ci szczegółowe instrukcje i zostanie wybrana optymalna godzina badania.
CO JEŚĆ W DNIACH POPRZEDZAJĄCYCH BADANIE?
Nie ma szczególnej diety zalecanej we wcześ-niejszych dniach, ale z oczywistych względów, jak przy każdym badaniu obrazowym, należy unikać potraw ciężkostrawnych i takich, które mogłyby spowodować powstanie dużej ilości gazów w przewodzie pokarmowym.
ANTYKONCEPCJA
Pacjenci po badaniu PET-TK nie są „radioaktywni”, niebezpieczni dla osób trzecich. Należy jednak pamiętać o konieczności antykoncepcji (również mężczyźni!). W wątpliwych przypadkach należy przed badaniem wykonać test ciążowy.
Tomografia komputerowa jest metodą diagnostyczną pozwalającą na uzyskanie obrazów tomograficznych (przekrojów) badanych części ciała, np. głowy. Wykorzystuje promienie rentgenowskie.
W celu dokładniejszego zobrazowania badanych struktur w niektórych badaniach podaje się pacjentowi dożylnie środek kontrastowy. Tak robi się też w diagnostyce chłoniaków. Pacjenci otrzymują kontrast, a zakres badania obejmuje szyję, klatkę piersiową, jamę brzuszną, miednicę mniejszą. W przypadku upośledzonej funkcji nerek lekarz decyduje, czy wskazane/bezpieczne jest wykonywanie badania z kontrastem.
Badania kreatyniny i TSH
Przed badaniem TK z kontrastem konieczne jest wykluczenie niewydolności nerek i nadczynności tarczycy, stąd wymagane jest badanie kreatyniny i TSH. Większość pracowni zadowala wynik z ostatnich 4 tygodni, choć optymalnie jest wyko-nać badanie nie później niż w tydzień przed planowanym badaniem.
PIJ WODĘ
W przypadku pozytywnej kwalifikacji do badania, w celu zapobiegania wystąpieniu uszkodzenia nerek, konieczne jest odpowiednie nawodnienie organizmu – 0,5-1 litr wody w ciągu godziny przed badaniem, następnie po podaniu kontrastu. Poza w/w procedurami nie jest wymagane specjalne przygotowanie do badania, chociaż część pracowni rekomenduje pozostawanie na czczo.
SPRAWDŹ, CZY JESTEŚ W CIĄŻY
Badanie tomografii nie powinno być wykonywane u kobiet w ciąży, poza bardzo wyjątkowymi sytuacjami, gdy korzyść z badania przewyższa ryzyko związane z napromieniowaniem płodu. Każda taka sytuacja musi być bezwzględnie omówiona wcześniej, a badanie wykonane z zastosowaniem odpowiedniej osłony.
Rezonans magnetyczny to nieinwazyjna metoda badania pozwalająca na obrazowanie wnętrza naszego ciała. Wykorzystuje zjawisko magnetycznego rezonansu jądrowego.
W odniesieniu do omawianych w niniejszym artykule chłoniaków, badanie rezonansu magnetycznego najczęściej rekomenduje się w przypadku zajęcia struktur oczodołu/ów lub ślinianek u pacjentów z pozawęzłowymi chłoniakami strefy brzeżnej typu MALT. Badanie to jest wykorzystywane również wtedy, kiedy istnieje podejrzenie zajęcia struktur ośrodkowego układu nerwowego lub kiedy monitoruje się skuteczność leczenia w obrębie w/w struktur. Badanie MRI jest nieszkodliwe dla człowieka, niemniej jednak w sytuacjach, w których stosuje się kontrast, może wystąpić reakcja alergiczna (rzadko) lub – podobnie jak w przypadku tomografii komputerowej – może dojść do uszkodzenia nerek.
Czas trwania badania zależy od tego, którą strukturę się ocenia i może trwać nawet 30-60 min. W trakcie pracy aparatu generowany jest hałas, który może być realną niedogodnością dla pacjenta, podobnie jak bardzo ciasna przestrzeń, w której przebywa badany pacjent; stąd zawsze należy poinformować personel o ewentualnej klaustrofobii (lękiem przed zamkniętymi/ciasnymi pomieszczeniami). W trakcie badania należy pozostawać nieruchomo. Nie jest konieczne specjalne przygotowywanie się do badania.
WAŻNE!
U osób, u których w ciele obecne są elementy metalowe (np. protezy, implanty, rozruszniki, opiłki żelaza itd.) za każdym razem należy ocenić, czy wykonanie badania rezonansu magnetycznego nie stwarza zagrożenia przemieszczenia się tych struktur w związku z działa-niem pola magnetycznego.
USG pozwala na zadowalającą oceną obwodowych węzłów chłonnych oraz tych umiejscowionych w jamie brzusznej i miednicy, z podaniem ich wymiarów.
Przy pomocy USG nie można ocenić węzłów chłonnych śródpiersia, ale rzadko mamy do czynienia z sytuacją, gdy do postępu choroby dochodzi wyłącznie w tej okolicy. USG to całkowicie „nieszkodliwe” badanie, które można powtarzać wielokrotnie, bez konsekwencji dla zdrowia chorego. Jest bezcennym uzupełnieniem opisanych wcześniej badań obrazowych, szczególnie w fazie obserwacji choroby.
Trzeba pamiętać o istotnych ograniczeniach:
- Badanie może nie być wiarygodne u osób otyłych, źle przygotowanych do badania.
- W praktyce nie ma możliwości wiarygodnego zarchiwizowania wyników badania, wydruki obrazów są złej jakości, a podstawowe znaczenie ma jego opis. Stąd zaleca się, by kolejne badania kontrolne były wykonywane, w miarę możliwości, przez jednego lekarza.
Badanie powinno być wykonywane na czczo, wskazana jest lekkostrawna dieta w dniach poprzedzających, a w niektórych przypadkach zażycie środków zmniejszających ilość gazów w przewodzie pokarmowym, np. Espumisan®.
Badanie endoultrasonograficzne (EUS) jest badaniem przydatnym w diagnostyce i monitorowaniu leczenia chłoniaków strefy brzeżnej zlokalizowanych w żołądku, jak również w diagnostyce chłoniaków płuc, kiedy konieczne jest wykluczenie zajęcia żołądka.
EUS jest metodą badania przewodu pokarmowego łączącą ocenę endoskopową i ultrasonograficzną. Za pomocą specjalnego endoskopu, który jest równocześnie wyposażony w głowicę USG, wykonuje się badanie wnętrza przewodu pokarmowego. EUS umożliwia obrazowanie ściany przewodu pokarmowego (w tym np. jej naciekania przez chłoniaka) i narządów przylegających do przełyku, żołądka, dwunastnicy. Podczas badania można wykonać zabiegi diagnostyczne i monitorujące skuteczność leczenia, tj. biopsję zmian nowotworowych makroskopowo (wizualnie) niezmienionej ściany żołądka.
Endoskop jest wprowadzany do przewodu pokarmowego przez jamę ustną po wcześniejszym znieczuleniu gardła, podobnie jak w przypadku gastroskopii. Ultrasonografia endoskopowa może być wykonywana bez znieczulenia lub w znieczuleniu ogólnym.
Z reguły przed badaniem lekarz zleci dodatkowe badania. Pacjenci chorujący na choroby przewlekłe, którzy wymagają regularnego przyjmowania leków, powinni skonsultować z lekarzem przyjęcie ich porannej dawki. Zwykle można ją przyjąć, popijając niewielką ilością wody, lecz w przypadku cukrzycy należy pominąć poranną dawkę zarówno insuliny, jak i doustnych leków przeciwcukrzycowych. U pacjentów przyjmujących leki przeciwkrzepliwe konieczne jest skonsultowanie wcześniej z lekarzem, czy i kiedy należy wstrzymać ich podawanie.
Po badaniu należy pozostawać na czczo, dopóki lekarz nie da odpowiednich zaleceń. Zazwyczaj pierwszy posiłek, zależnie od rodzaju zabiegu, można spożyć minimum 2 godziny po ustąpieniu znieczulenia miejscowego gardła. Zwykle po ultrasonografii endoskopowej można opuścić szpital w dniu badania. Jeśli zabieg endoskopowy wykonywany jest w warunkach ambulatoryjnych w znieczuleniu ogólnym, nie wolno prowadzić pojazdów mechanicznych w tym dniu i konieczna jest opieka drugiej osoby przy powrocie do domu.
NIE JEDZ I NIE PIJ
Badanie wykonywane jest na czczo, co oznacza, że nie wolno spożywać ani pokarmów, ani płynów, w tym wody. Ostatni lekki posiłek przed badaniem można spożyć dzień wcześniej wieczorem, o ile nie zadecydowano inaczej.
Szpik kostny najczęściej pobiera się zazwyczaj z górnego tylnego kolca kości biodrowej. Zabieg pobrania szpiku wykonywany jest w znieczuleniu miejscowym i trwa do 10 minut, z czego najwięcej czasu zajmuje odpowiednie ułożenie pacjenta i oczekiwanie na rozpoczęcie działania znieczulenia.
Biopsja aspiracyjna szpiku kostnego polega na pobraniu płynnej frakcji szpiku, w której zawarte są komórki. Trepanobiopsja oznacza natomiast pobranie fragmentu tkanki kostnej wraz ze szpikiem, co pozwala na badanie pod mikroskopem utkania szpiku kostnego. W FL i większości MZL badania szpiku nie są konieczne do postawienia rozpoznania. Służą one jedynie do ustalenia stadium zaawansowania. Wyjątkiem są: śledzionowy chłoniak strefy brzeżnej, gdzie badanie szpiku jest wykorzystywane do rozpoznania (chociaż tak naprawdę pewne rozpoznanie można postawić tylko na podstawie badania histopatologicznego usuniętej śledziony, czego nie robi się w codziennej praktyce klinicznej) i makroglobulinemia Waldenströma, w której konieczne jest udowodnienie zajęcia szpiku przez chłoniaka limfoplazmocytowego.
MORFOLOGIA
Morfologia najczęściej nie ma znaczenia dla rozpoznawania chłoniaków – może być prawidłowa i nie pojawią się w niej najmniejsze niepokojące odchylenia. Jest jednak podstawowym badaniem, które pozwala nam monitorować stan organizmu w trakcie leczenia, decydującym o możliwości podania kolejnego cyklu chemioterapii. Więcej o badaniu morfologii w części B.
Jednym z wyjątków jest chłoniak śledzionowy strefy brzeżnej – w tym przypadku typowo mamy do czynienia ze zwiększeniem liczby krwinek białych wynikającym ze zwiększenia liczby limfocytów. Tej sytuacji może towarzyszyć niedokrwistość (czyli obniżone stężenie hemoglobiny) i obniżenie liczby płytek krwi. W przypadku znacznego obniżenia tych parametrów będziemy podejmować decyzję o rozpoczęciu leczenia.
OCENA FUNKCJI NEREK I WĄTROBY
Kreatynina, mocznik i kwas moczowy jako para-metry funkcji nerek; transaminazy (AST i ALT), gammaglutamyltranspeptydaza (GGTP), fosfataza zasadowa (ALP), bilirubina całkowita i bez-pośrednia oraz inne – jako ocena funkcji wątroby.
Dehydrogenaza mleczanowa LDH
Badanie aktywności LDH wykonujemy we wszystkich nowotworach hematologicznych. Świadczy o zwiększonej aktywności proliferacyjnej nowotworu. Aktywność LDH może być też zwiększona w innych sytuacjach, np. w chorobach wątroby, zawale serca, chorobach mięśni i innych chorobach, w przebiegu których dochodzi do uszkodzenia komórek/tkanek. LDH ma znaczenie pro-gnostyczne w wielu chłoniakach.
BADANIA WIRUSOLOGICZNE
Badania w celu wykluczenia wirusowego zapalenia wątroby typu B (antygen HBs, przeciwciała anty-HBs, przeciwciała anty-HBc, materiał genetyczny wirusa – HBV DNA) i wirusowego zapalenia wątroby typu C (przeciwciała anty-HCV, materiał genetyczny wirusa – HCV RNA) oraz zakażenia wirusem HIV (anty-HIV/p24). Pacjenci po przebytym WZW typu B muszą być przed rozpoczęciem immunochemioterapii ocenieni przez lekarza chorób zakaźnych w celu ustalenia wskazań do równoczesnego leczenia p/wirusowego.
Elektroforeza białek surowicy proteinogram
Proteinogram jest badaniem niezbędnym w diagnostyce makroglobulinemii Waldenströma. Po pierwsze pozwala na identyfikację, że w danej surowicy jest obecne białko monoklonalne, po drugie pozwala w ilościowy sposób ocenić jego ilość. Badanie proteinogramu wykonuje się również w przypadku chłoniaków strefy brzeżnej ze względu na częste występowanie gammapatii monoklonalnej. U pacjentów chorych na chłoniaka grudkowego badanie to nie jest obowiązkowe, może być jednak przydatne w wybranych sytuacjach.
Białko monoklonalne w surowicy
Stwierdzenie obecności białka monoklonalnego ma szczególne znaczenie w przypadku diagnostyki makroglobulinemii Waldenströma. W tej sytuacji typowo stwierdza się obecność białka monoklonalnego klasy IgM, jednak samo stwierdzenie obecności białka IgM nie jest równoznaczne z rozpoznaniem makroglobulinemii Waldenströma. Jego obecność można stwierdzić również np. w przypadku chłoniaków strefy brzeżnej lub szpiczaka plazmocytowego. W nielicznych przypadkach chłoniaków limfoplazmocytowych, które nie wydzielają IgM, możliwe jest stwierdzenie obecności immunoglobuliny mono-klonalnej klasy IgG lub IgA.
BIAŁKO MONOKLONALNE W MOCZU
Podobnie, jak w surowicy, można wykryć białko monoklonalne w moczu. Ważną informacją jest dobowa utrata białka z moczem, stąd dla pełnej oceny konieczna jest jego dobowa zbiórka.
STĘŻENIE BETA-2 MIKROGLOBULINY
Ocenę tego parametru wykonujemy w celu oceny rokowania.
BADANIE KOAGULOGRAMU
Badanie to ocenia funkcję układu krzepnięcia. Wykonywane jest rutynowo w większości sytuacji klinicznych, szczególne znaczenie ma jednak u pacjentów chorych na makroglobulinemię Waldenströma, u których białko IgM może doprowadzać do zaburzeń krzepnięcia.
W NIEKTÓRYCH PRZYPADKACH ZLECA SIĘ RÓWNIEŻ
- nakłucie lędźwiowe z badaniem płynu mózgowo-rdzeniowego,
- krioglobuliny i kriokryt,
- badania w kierunku Helicobacter pylorii,
- kolonoskopię,
- bronchoskopię,
- badanie laryngologiczne,
- badanie ultrasonograficzne tarczycy,
- ocenę funkcji hormonalnej tarczycy (anty-TPO, TSH, fT4),
- badanie ultrasonograficzne piersi lub innych struktur,
- badanie dermatologiczne, dokumentację fotograficzną zmian,
- badanie neurologiczne, biopsję nerwu, badanie ENG,
- biopsję nerki,
- u kobiet w wieku rozrodczym konieczne jest wykluczenie ciąży.
LECZENIE chłoniaków indolentnych B-komórkowych
W leczeniu chłoniaków indoletnych zastosowanie mają różne schematy leczenia.
Jak już wiesz, nie muszą być one wdrożone od razu po zdiagnozowaniu choroby, a początkowo pacjent może pozostawiać w obserwacji, czyli tzw. strategii watch&wait. Z czasem, jeśli stadium zaawansowania choroby będzie tego wymagało, zostanie Ci zaproponowane leczenie dobrane do choroby, Twojego ogólnego zdrowia oraz chorób współistniejących.
STRATEGIA WATCH&WAIT (OBSERWUJ I CZEKAJ)
Wielu pacjentów w momencie rozpoznania chłoniaka indolentnego ma stabilną chorobę, bez towarzyszących objawów klinicznych, w związku z czym nie wymaga rozpoczynania leczenia.
Wskazana jest jedynie regularna obserwacja w ramach poradni hematologicznej lub onkologicznej. To dobry czas, by zająć się zaniedbanymi kwestiami zdrowotnymi, takimi jak:
W przypadku chłoniaka grudkowego w I, ewentualnie II stadium zaawansowania klinicznego, ale wtedy, kiedy węzły chłonne są położone blisko siebie, a ich wymiary nie są duże, można podjąć decyzję o kwalifikacji do radio-terapii, mając nadzieję, że będzie to leczenie radykalne (tzn. pozwoli na wyleczenie chłoniaka). Konieczne jest jednak wykluczenie nawet minimalnego zajęcia szpiku, co w praktyce jest bardzo trudne.
W zaawansowanym stadium klinicznym chłoniaka grudkowego posługujemy się tzw. kryteriami GELF (Groupe d’Etude des Lymphomes Folliculaires Criteria). Rozpoczęcie leczenia rekomenduje się u osób, u których można stwierdzić co najmniej jedną z poniższych sytuacji:
1. Zajęcie co najmniej 3 lokalizacji węzłowych, każda >3 cm średnicy
2. Objawy ucisku na istotne narządy
3. Obecność jakiejkolwiek zmiany >7 cm średnicy
4. Obecność objawów B tj. gorączki lub nocnych potów lub utraty masy ciała
5. Powiększenie śledziony poniżej linii pępka
6. Wysięk (płyn) w opłucnej lub otrzewnej
7. NEUTROPENIA (Obniżenie liczby NEUTROFILÓW <1 x 109/L), małopłytkowość (liczba płytek krwi <100 x 109/L) wynikające z zajęcia szpiku
8. Faza białaczkowa chłoniaka (>5 x109/L limfocytów chłoniaka grudkowego we krwi obwodowej)
Tymi samymi kryteriami posługujemy się również w przypadku węzłowych chłoniaków strefy brzeżnej.
Każda zmiana ogniskowa może przy spadku odporności prowadzić do sepsy.
W przypadku przebycia wcześniej wirusowego zapalenia wątroby może dojść do jego reaktywacji, stąd wykonuje się dodatkowe badania, by to wykluczyć, a w razie potrzeby leczyć.
Pacjenci palący powinni rozważyć rzucenie nałogu (palenie znacząco zwiększa ryzyko infekcji i ogranicza wydolność płuc).
Chłoniaki to choroby nowotworowe układu immunologicznego. Jednym z pierwszych objawów jest zwiększenie częstości infekcji, które mogą przybierać przewlekły bądź nawrotowy charakter.
Należy co roku szczepić się p/grypie, można rozważyć szczepienie przeciw pneumokokom (osoby z częstymi zapaleniami oskrzeli/płuc) czy przeciwko wirusowi VZV (zmniejszenie ryzyka półpaśca). Szczepienia p/Sars-Cov-2 przyjmuj także zgodnie z aktualnymi wytycznymi.
Ostatnim, choć nie najmniej ważnym zadaniem, jest zdrowy styl życia. Powodzenie przyszłego leczenia zależy od stanu czynnościowego organizmu. Powinno się okres obserwacji przed rozpoczęciem leczenia potraktować jak trening przed wzięciem udziału w olimpiadzie tak, by w momencie „startu w zawodach” być w jak najlepszej formie.
Nie powinniśmy zapominać o regularnym wysiłku fizycznym, adekwatnej ilości snu, unikaniu przemęczenia, a także zdrowej, zbilansowanej diecie. W tym czasie Twoje życie i praca zawodowa powinna przebiegać normalnie i w jak najzdrowszym wydaniu. To najlepszy czas, jaki masz. Niepowodzenia są rzadkie, nie ma zupełnie działań niepożądanych leków. Jedyne ograniczenia wiążą się z potrzebą unikania infekcji, dużych skupisk ludzkich i – o ile jest to możliwe – środków komunikacji publicznej. W miarę możliwości spacer do pracy lub pojechanie na rowerze jest zawsze lepszym rozwiązaniem.
Trzeba pamiętać, że powiększenie (nawet znaczne) węzłów chłonnych wtórne do infekcji lub lokalnego stanu zapalnego może być okresowe i z czasem ustępuje.
Podobnie liczba limfocytów, np. w przebiegu śledzionowego chłoniaka strefy brzeżnej może wykazywać znaczne wahania, na przykład w odpowiedzi na infekcję lub też bez uchwytnych przyczyn. Dlatego zawsze należy upewnić się, że rozpoczynanie leczenia jest konieczne. Decyzję zarówno o kwalifikacji do leczenia, jak i kontynuowaniu obserwacji, podejmuje lekarz.
STADIUM ZAAWANSOWANIA KLINICZNEGO I CZYNNIKI RYZYKA
Określenie stadium zaawansowania chłoniaka pozwala na podjęcie decyzji o potrzebie rozpoczęcia leczenia oraz wybór optymalnej terapii. Wbrew intuicji, z wyjątkiem przypadków z bardzo dużą masą guza lub zajęciem wybranych okolic (np. rzadkim w chłoniakach indolentnych zajęciem ośrodkowego układu nerwowego), rokowanie w małym stopniu zależy od stadium zaawansowania klinicznego.
W przypadku chłoniaka grudkowego w I, ewentualnie II stadium zaawansowania klinicznego, ale wtedy, kiedy węzły chłonne są położone blisko siebie, a ich wymiary nie są duże, można podjąć decyzję o kwalifikacji do radio-terapii, mając nadzieję, że będzie to leczenie radykalne (tzn. pozwoli na wyleczenie chłoniaka). Konieczne jest jednak wykluczenie nawet minimalnego zajęcia szpiku, co w praktyce jest bardzo trudne.
W zaawansowanym stadium klinicznym chłoniaka grudkowego posługujemy się tzw. kryteriami GELF (Groupe d’Etude des Lymphomes Folliculaires Criteria). Rozpoczęcie leczenia rekomenduje się u osób, u których można stwierdzić co najmniej jedną z poniższych sytuacji:
1. Zajęcie co najmniej 3 lokalizacji węzłowych, każda >3 cm średnicy
2. Objawy ucisku na istotne narządy
3. Obecność jakiejkolwiek zmiany >7 cm średnicy
4. Obecność objawów B tj. gorączki lub nocnych potów lub utraty masy ciała
5. Powiększenie śledziony poniżej linii pępka
6. Wysięk (płyn) w opłucnej lub otrzewnej
7. NEUTROPENIA (Obniżenie liczby NEUTROFILÓW <1 x 109/L), małopłytkowość (liczba płytek krwi <100 x 109/L) wynikające z zajęcia szpiku
8. Faza białaczkowa chłoniaka (>5 x109/L limfocytów chłoniaka grudkowego we krwi obwodowej)
Tymi samymi kryteriami posługujemy się również w przypadku węzłowych chłoniaków strefy brzeżnej.
Posługujemy się klasyfikacją z Lugano, będącą modyfikacją wcześniej stosowanej klasyfikacji z Ann Arbor. U większości z pacjentów chorobę rozpoznaje się jako proces uogólniony (stadium III-IV), jedynie w pojedynczych przypadkach chłoniaka grudkowego rozpoznajemy w stadium zlokalizowanym (I-II).
Przy naciekach ograniczonych do jednego narządu opisujemy to jako IE (gdzie „E” pochodzi od angielskiego słowa extranodal, znaczącego tyle co „pozawęzłowy”).
Nie ocenia się stadium zaawansowania tych chłoniaków (we wszystkich przypadkach zajęty jest szpik kostny, stąd z definicji każdy chory miałby stadium IV).
Do oceny rokowania w poszczególnych chłoniakach służą ponadto odpowiednie indeksy prognostyczne. Indeksów tych jest co najmniej kilka dla każdego chłoniaka, a pacjenci mogą się spotkać z nimi niejednokrotnie w swoich kartach wypisowych.
Najpowszechniej używane indeksy to:
- FLIPI lub PRIMA-PI dla chłoniaka grudkowego
- MALT-IPI lub zrewidowany indeks MALT-IPI dla chłoniaków strefy brzeżnej typu MALT,
- MZL-IPI opracowany niedawno dla wszystkich chłoniaków strefy brzeżnej,
- IPSSWM, czyli Międzynarodowy Indeks Prognostyczny dla Makroglobulinemii Waldenströma lub R-IPSSWM, czyli zrewidowany indeks IPSSWM.
O rokowaniu i interpretacji czynników ryzyka zawsze rozmawiaj z lekarzem.
W internecie można znaleźć kalkulatory do samodzielnego obliczenia powyższych indeksów. Korzystanie z nich jest je-nak niewskazane. Większość z nich opracowano w czasie, gdy mieliśmy do dyspozycji jedynie immunochemioterapię. Ich przydatność jest mniejsza obecnie, gdy mamy możliwość stosowania nowoczesnych metod immunoterapii i leków ukierunkowanych molekularnie.
KWALIFIKACJA DO LECZENIA
Leczenie chłoniaka indolentnego rozpoczyna się dopiero, gdy spełniony jest przynajmniej jeden z opisanych niżej warunków. Ważne byś zrozumiał, że odraczanie leczenia nie jest dla Ciebie niebezpieczne i nie pogarsza Twojego rokowania.
W przypadku chłoniaka grudkowego w I, ewentualnie II stadium zaawansowania klinicznego, ale wtedy, kiedy węzły chłonne są położone blisko siebie, a ich wymiary nie są duże, można podjąć decyzję o kwalifikacji do radio-terapii, mając nadzieję, że będzie to leczenie radykalne (tzn. pozwoli na wyleczenie chłoniaka). Konieczne jest jednak wykluczenie nawet minimalnego zajęcia szpiku, co w praktyce jest bardzo trudne.
W zaawansowanym stadium klinicznym chłoniaka grudkowego posługujemy się tzw. kryteriami GELF (Groupe d’Etude des Lymphomes Folliculaires Criteria). Rozpoczęcie leczenia rekomenduje się u osób, u których można stwierdzić co najmniej jedną z poniższych sytuacji:
1. Zajęcie co najmniej 3 lokalizacji węzłowych, każda >3 cm średnicy
2. Objawy ucisku na istotne narządy
3. Obecność jakiejkolwiek zmiany >7 cm średnicy
4. Obecność objawów B tj. gorączki lub nocnych potów lub utraty masy ciała
5. Powiększenie śledziony poniżej linii pępka
6. Wysięk (płyn) w opłucnej lub otrzewnej
7. NEUTROPENIA (Obniżenie liczby NEUTROFILÓW <1 x 109/L), małopłytkowość (liczba płytek krwi <100 x 109/L) wynikające z zajęcia szpiku
8. Faza białaczkowa chłoniaka (>5 x109/L limfocytów chłoniaka grudkowego we krwi obwodowej)
Tymi samymi kryteriami posługujemy się również w przypadku węzłowych chłoniaków strefy brzeżnej.
W przypadku chłoniaka grudkowego w I, ewentualnie II stadium zaawansowania klinicznego, ale wtedy, kiedy węzły chłonne są położone blisko siebie, a ich wymiary nie są duże, można podjąć decyzję o kwalifikacji do radio-terapii, mając nadzieję, że będzie to leczenie radykalne (tzn. pozwoli na wyleczenie chłoniaka). Konieczne jest jednak wykluczenie nawet minimalnego zajęcia szpiku, co w praktyce jest bardzo trudne.
W zaawansowanym stadium klinicznym chłoniaka grudkowego posługujemy się tzw. kryteriami GELF (Groupe d’Etude des Lymphomes Folliculaires Criteria). Rozpoczęcie leczenia rekomenduje się u osób, u których można stwierdzić co najmniej jedną z poniższych sytuacji:
1. Zajęcie co najmniej 3 lokalizacji węzłowych, każda >3 cm średnicy
2. Objawy ucisku na istotne narządy
3. Obecność jakiejkolwiek zmiany >7 cm średnicy
4. Obecność objawów B tj. gorączki lub nocnych potów lub utraty masy ciała
5. Powiększenie śledziony poniżej linii pępka
6. Wysięk (płyn) w opłucnej lub otrzewnej
7. NEUTROPENIA (Obniżenie liczby NEUTROFILÓW <1 x 109/L), małopłytkowość (liczba płytek krwi <100 x 109/L) wynikające z zajęcia szpiku
8. Faza białaczkowa chłoniaka (>5 x109/L limfocytów chłoniaka grudkowego we krwi obwodowej)
Tymi samymi kryteriami posługujemy się również w przypadku węzłowych chłoniaków strefy brzeżnej.
Leczenie powinno rozpoczynać się wtedy, kiedy stwierdza się jedno z poniższych kryteriów:
- Progresywna/objawowa splenomegalia
- Niedokrwistość (stężenie hemoglobiny <10 g/dL)
- Małopłytkowość (liczba płytek KRWI <80 x 109/L)
- Neutropenia (liczba neutrofilów <1 x 109/L)
Leczenie rozpoczyna się, gdy spełnione jest przynajmniej jedno z poniższych kryteriów klinicznych lub laboratoryjnych:
- występowanie objawów ogólnych związanych z chorobą
- amyloidoza związana z MW
- objawowa neuropatia spowodowana MW
- objawowa hepatomegalia i/lub splenomegalia
- niedokrwistość (stężenie hemoglobiny ≤10 g/dL)
- małopłytkowość (liczba płytek krwi <100 x 109/L)
- objawowe powiększenie narządu i/lub objawowe nacieczenie narządu pozalimfatycznego
- objawowe lub znaczne powiększenie węzłów chłonnych (najdłuższy wymiar ≥5 cm)
- nefropatia związana z MW
- stężenie IgM >60 g/L (Kryterium stężenia IgM nie jest powszechnie uznanym wskazaniem i wiele rekomendacji
nie uwzględnia tego parametru przy podejmowaniu decyzji o leczeniu.) - immunologiczna niedokrwistość hemolityczna i/lub immunologiczna małopłytkowość
- objawowa krioglobulinemia/ choroba zimnych aglutynin
- występowanie objawów zespołu nadlepkości
LECZENIE CHŁONIAKA GRUDKOWEGO
LECZENIE I LINII
Leczenie chłoniaka grudkowego różni się w zależności od stadium zaawansowania klinicznego. W stadiach ograniczonych bez znacznie powiększonych węzłów chłonnych można rozważyć zastosowanie radioterapii. Wiele ośrodków na świecie stosuje jednak w takich przypadkach same przeciwciała monoklonalne (rytuksymab) lub immunochemioterapię, podobnie jak w stadiach zaawansowanych.
W przypadku stadiów zaawansowanych standardem jest immunochemio-terapia (połączenie przeciwciał monoklonalnych z cytostatykami) lub immunoterapia (połączenie przeciwciał monoklonalnych z lekiem immunomodulującym - lenalidomidem).
Nawet w przypadku podjęcia już decyzji o leczeniu, rzadko rozpoczyna się je ze wskazań życiowych - masz zwykle czas na uporządkowanie spraw pilnych czy nawet pojechanie na urlop. Zawsze zapytaj o to lekarza prowadzącego - leczenie można zazwyczaj odroczyć o parę tygodni, nie powinno się go natomiast przerywać.
W przypadku chłoniaka grudkowego w I, ewentualnie II stadium zaawansowania klinicznego, ale wtedy, kiedy węzły chłonne są położone blisko siebie, a ich wymiary nie są duże, można podjąć decyzję o kwalifikacji do radio-terapii, mając nadzieję, że będzie to leczenie radykalne (tzn. pozwoli na wyleczenie chłoniaka). Konieczne jest jednak wykluczenie nawet minimalnego zajęcia szpiku, co w praktyce jest bardzo trudne.
W zaawansowanym stadium klinicznym chłoniaka grudkowego posługujemy się tzw. kryteriami GELF (Groupe d’Etude des Lymphomes Folliculaires Criteria). Rozpoczęcie leczenia rekomenduje się u osób, u których można stwierdzić co najmniej jedną z poniższych sytuacji:
1. Zajęcie co najmniej 3 lokalizacji węzłowych, każda >3 cm średnicy
2. Objawy ucisku na istotne narządy
3. Obecność jakiejkolwiek zmiany >7 cm średnicy
4. Obecność objawów B tj. gorączki lub nocnych potów lub utraty masy ciała
5. Powiększenie śledziony poniżej linii pępka
6. Wysięk (płyn) w opłucnej lub otrzewnej
7. NEUTROPENIA (Obniżenie liczby NEUTROFILÓW <1 x 109/L), małopłytkowość (liczba płytek krwi <100 x 109/L) wynikające z zajęcia szpiku
8. Faza białaczkowa chłoniaka (>5 x109/L limfocytów chłoniaka grudkowego we krwi obwodowej)
Tymi samymi kryteriami posługujemy się również w przypadku węzłowych chłoniaków strefy brzeżnej.
Monoterapia z rytuksymabem, którą czasem pro-ponuje się pacjentom z małą masą guza, to zwy-kle 4 dawki podawane w odstępie tygodnia, z na-stępowym leczeniem podtrzymującym (dawki le-ku co 2-3 miesiące w kolejnych 2 latach).
Immunochemioterapia jest połączeniem dwóch metod: immunoterapii wykorzystującej mechanizmy immunologiczne oraz klasycznej chemioterapii.
W praktyce oznacza to zastosowanie tzw. przeciwciała monoklonalnego skierowanego przeciwko cząsteczce CD20 – obecnej na powierzchni limfocytów B – czyli R rytuksymabu lub O obinutuzumabu i jednego z trzech protokołów chemioterapii: CVP (cyklofosfamidu, winkrystyny i prednizonu), CHOP (CVP z dodatkiem antracykliny) czy B bendamustyny.
Protokoły te różnią się pomiędzy sobą – konkretne rozwiązanie zaproponuje lekarz prowadzący, biorąc pod uwagę charakterystykę Twojej choroby, choroby współistniejące i potencjalne działania niepożądane.
R-CVP | O-CVP
Potencjalnie najsłabiej działa R-CVP/O-CVP jednak za tym schematem przemawia zadowalająca skuteczność w razie możliwości leczenia podtrzymującego przeciwciałami (patrz dalej) i najlepszy profil toksyczności. To preferowany sposób leczenia u osób starszych z licznymi chorobami towarzyszącymi.
RB | OB
Młodszym chorym proponuje się zwykle leczenie RB/OB. Ten najbardziej popularny w Europie schemat jednak u części pacjentów wywołuje głębokie cytopenie (niższa ilość białych krwinek, czerwonych krwinek lub/i płytek krwi), czyli przekładając na język praktyczny – zwiększa ryzyko infekcji, niedokrwistości i pojawienia się objawów skazy krwotocznej. Co więcej, może w sposób długotrwały upośledzać funkcję limfocytów, zmniejszając w przyszłości skuteczność nowoczesnych metod immunoterapii, takich jak terapie CAR-T.
R-CHOP | O-CHOP
Schemat R-CHOP/O-CHOP jest podstawowym schematem leczenia I linii chłoniaków agresywnych, zawiera doksorubicynę (antracyklinę) – lek potencjalnie uszkadzający serce. Rekomendowany jest w przypadku podejrzenia możliwości transformacji chłoniaka indolentnego w proces agresywny, np. podtyp FL G3b lub obecność zmian o wysokiej aktywności metabolicznej w badaniu PET-TK.
U pacjentów leczonych schematem R-CHOP/O-CHOP dochodzi do utraty włosów, które odrastają po zakończeniu leczenia. W przypadku kwalifikacji do leczenia tym schematem, niezależnie od wieku, należy u każdego przed rozpoczęciem leczenia dokonać oceny układu krążenia (konsultacja kardiologiczna, badanie echokardiograficzne z oceną frakcji wyrzutowej).
U chorych z niewydolnością serca nie należy stosować doksorubicyny ze względu na jej działanie kardiotoksyczne.
_________
Leczenie immunochemioterapią będzie się odbywać w dziennym ośrodku leczenia lub w czasie krótkich 1-2 dniowych hospitalizacji, powtarzanych co 3-4 tygodnie.
Kolejne cykle immunochemioterapii wyglądają podobnie. Wyjątkiem jest pierwszy cykl u chorych leczonych obinutuzumabem, gdzie przeciwciała monoklonalne podaje się również w dniu 8 i 15, co wymaga dodatkowej obecności w szpitalu.
Część chorych, zwłaszcza w razie wyboru schematu R-CVP/O-CVP, może kontynuować pracę zawodową, choć należy się liczyć z gorszym samopoczuciem w pierwszych dniach po podaniu leków.
_________
LECZENIE PODTRZYMUJĄCE
O ile uzyskasz co najmniej częściową odpowiedź na zastosowane leczenie, będziesz mógł kontynuować leczenie podtrzymujące przeciwciałami monoklonalnymi przez 2 kolejne lata.
Wiąże się ono z podaniem leków raz na 2-3 miesiące i nie przeszkadza w prowadzeniu normalnego życia, w tym pracy zarobkowej.
Warto zaznaczyć, że leczenie podtrzymujące jest zalecane, ale nie obowiązkowe. W badaniach oceniających wpływ leczenia podtrzymującego na przeżycie stwierdzono, że wydłuża ono tak zwane przeżycie wolne od progresji, nie wydłuża natomiast przeżycia całkowitego. Co to oznacza dla Ciebie? Że dłużej pozostajesz bez poczucia choroby, ale sumarycznie żyjesz tak samo długo, bez względu na to czy otrzymasz lub nie otrzymasz leczenie podtrzymujące. Jest to bardzo ważna informacja, ponieważ w trakcie pandemii COVID-19, ze względu na ryzyko potencjalnie zagrażających życiu infekcji, rezygnowaliśmy z leczenia podtrzymującego, szczególnie u osób niezaszczepionych.
Decyzję o przerwaniu lub niestosowaniu leczenia podtrzymującego podejmujemy również wtedy, kiedy masz np. długo utrzymującą się neutropenię (obniżenie liczby neutrofilów we krwi) lub częste powikłania infekcyjne.
Alternatywą dla immunochemioterapii jest zastosowanie w pierwszej linii leczenia chłoniaka grudkowego wyłącznie immunoterapii: protokołu R2 zawierającego lenalidomid i rytuksymab. Nazwą handlową lenalidomidu jest Revlimid®, stąd nazwa schematu R2.
Lenalidomid podawany jest raz na dobę w dniach 1-21 każdego 28-dniowego cyklu przez okres 6 miesięcy. Dalsze leczenie uzależnione jest od odpowiedzi uzyskanej po 6 cyklach; u pacjentów zyskujących odpowiedź za-sadniczo kontynuowane jest do 18 cykli. Rytuksymab w tym protokole kontynuowany jest do 12 cykli.
Schemat ten charakteryzuje się innymi działaniami niepożądanymi niż w przypadku immunochemioterapii: obserwujemy mniej powikłań infekcyjnych, pomimo częstych neutropenii, natomiast znacznie więcej reakcji uczuleniowych, zmian skórnych czy zaburzeń czynnościowych ze strony przewodu pokarmowego.
Immunochemioterapia może być lepiej tolerowawana niż schemat R2. Zwykle rekomendujemy ją jako alternatywę w leczeniu II linii (przy nawrocie choroby lub jej oporności na wcześniejsze leczenie).
Jak już wspomniano, chłoniak grudkowy jest chłoniakiem nieuleczalnym i u większości chorych należy spodziewać się nawrotu choroby. Kiedy to może nastąpić?
W medycynie zaczyna funkcjonować pojęcie „czynnościowego wyleczenia” oznaczającego tak głęboką i długotrwałą remisję choroby, że nie dochodzi do jej wznowy do końca życia. Najlepiej zobrazują to dane z badania klinicznego „PRIMA”, w którym chorych leczonych jednym z 3 wyżej opisanych schematów immunochemioterapii w losowy sposób poddawano leczeniu podtrzymującemu z rytuksymabem. W grupie kontrolnej leczenie było zakończone po 6 cyklach immunochemioterapii.
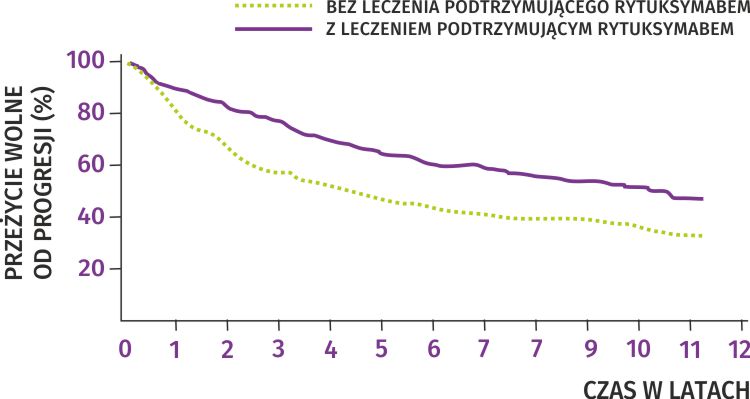
Powyższy wykres przedstawia czas do progresji choroby.
Więcej niż połowa z chorych, u których zastosowano leczenie podtrzymujące z rytuksymabem, nie miała wznowy choroby w 10 lat po rozpoczęciu leczenia.
Jak można zauważyć, rokowanie jest bardzo dobre, może z wyjątkiem 20% chorych, u których do wznowy doszło w pierwszych 2 latach (tzw. POD24, czyli progresja choroby w pierwszych 24 miesiącach – uważana za najsilniejszy, negatywny czynnik prognostyczny).
Jeszcze lepszych rezultatów należy się spodziewać, jeżeli zastosujemy obinutuzumab. W badaniu porównującym oba przeciwciała nie ma jeszcze wystarczająco długich obserwacji, by móc pokazać tak jednoznaczne wyniki, wiemy już jednak, że leczenie obinutuzumabem o ¼ zmniejszyło liczbę chorych z progresją w pierwszych 2 latach od jego rozpoczęcia.
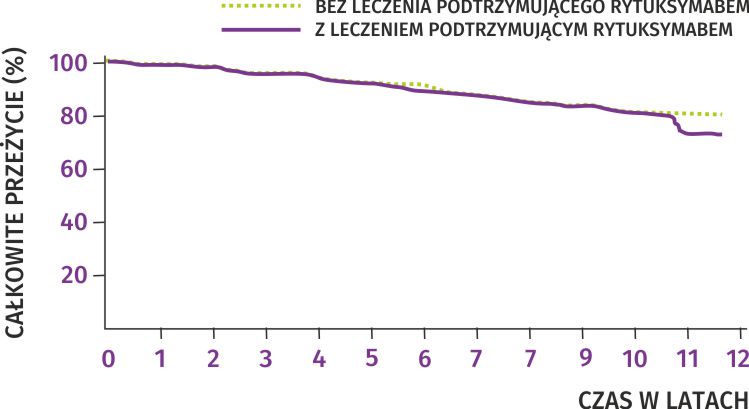
Drugi wykres przedstawia długość życia.
W 10 lat po rozpoczęciu leczenia żyło 80% pacjentów, niezależnie od tego, czy poddano ich leczeniu podtrzymującemu rytuksymabem, czy nie. Biorąc pod uwagę, że u większości z pacjentów rozpoznano chłoniaka po 65 roku życia, część z nich zmarła z innych, niezależnych od chłoniaka przyczyn.
W badaniach klinicznych bada się obecnie jako leczenie I linii immunoterapię z tzw. przeciwciałami bispecyficznymi/dwuswoistymi, zaaprobowanymi do stosowania w 3 linii leczenia. To bardzo silnie działające leki wykorzystujące układ immunologiczny. Doprowadzają one do bardzo głębokiej remisji choroby, z czym część badaczy wiąże nadzieję na możliwość całkowitego wyleczenia chłoniaka grudkowego.
LECZENIE WZNOWY/OPORNOŚCI FL
Postępowanie w przypadku choroby nawrotowej zależy od wielu czynników. Najbardziej niepokojąca z klinicznego punktu widzenia jest sytuacja, gdy do nawrotu dochodzi wcześnie, tj. w ciągu 24 miesięcy od rozpoczęcia leczenia. Jak już wcześniej wspomniano, taka sytuacja jest określana jako POD24 i zawsze wymaga pilnego działania.
Późny nawrót nie oznacza konieczności pilnego rozpoczęcia leczenia, które odraczamy do czasu spełnienia kryteriów - takich samych jak przy leczeniu I linii. A zatem leczenie otrzymują tylko ci pacjenci, którzy spełniają kryteria rozpoczynania leczenia.
- W leczeniu stosuje się protokoły immunochemioterapii omówione wcześniej lub protokół R2.
- Optymalnie wybiera się protokoły, które nie były jeszcze stosowane.
- W przypadku długo utrzymującej się odpowiedzi po leczeniu pierw-szej i kolejnych linii możliwe jest jednak zastosowanie tego samego protokołu. W przypadku POD24 zawsze konieczna jest zmiana na in-ny protokół.
- Warto zapytać lekarza o dostępność leczenia w ramach badań kli-nicznych, w których testujemy alternatywne metody immunoterapii lub przeciwciała bispecyficzne/dwuswoiste w skojarzeniu np. z leka-mi immunomodulującymi.
- W przypadku każdego nawrotu chłoniaka sprawdzamy, czy mamy do czynienia z tą samą chorobą, co wcześniej, czy też uległa zmianie, tj. transformacji do chłoniaka agresywnego. W przypadku transformacji obowiązują zupełnie inne zasady leczenia.
Monoterapia z rytuksymabem, którą czasem pro-ponuje się pacjentom z małą masą guza, to zwy-kle 4 dawki podawane w odstępie tygodnia, z na-stępowym leczeniem podtrzymującym (dawki le-ku co 2-3 miesiące w kolejnych 2 latach).
Mosunetuzumab jest najbardziej efektywną immunoterapią, jaką – zgodnie z rejestracją – może-my zastosować u chorych na FL począwszy od III linii leczenia. Jest on refundowany dla polskich pacjentów w ramach programu lekowego NFZ od lipca 2024 roku. Jest to przeciwciało bispecyficzne (dwuswoiste), które tworzy swego rodzaju synapsę (połączenie) pomiędzy nowotworowym limfocytem B a limfocytem T, który ma za zadanie zabić komórkę nowotworową. Przy wszystkich różnicach, mechnizm działania tego leku jest bardzo podobny do terapii CAR-T.
W pierwszych dwóch cyklach leczenia stopniowo zwiększa się dawkę leku, osiągając docelową w cyklu trzecim. Czas trwania leczenia zależy od jego skuteczności i trwa albo 8 cykli (w przypadku pacjentów, którzy osiągnęli remisję całkowitą po 8 cyklach), albo 17 cykli (w przypadku pacjentów, którzy osiągnęli remisję częściową lub stabilizację choroby).
Na chwilę obecną w Polsce terapie CAR-T nie są refundowane w leczeniu opornego/nawrotowego chłoniaka grudkowego.
Zastosowanie wysokodawkowanej chemioterapii wspomaganej przeszczepieniem autologicznych („własnych”) komórek krwiotwórczych bądź prze-szczepienie allogenicznych komórek krwiotwórczych (od dawcy rodzinnego bądź niespokrewnionego) w leczeniu pacjentów chorych na opornego/nawrotowego chłoniaka grudkowego jest obecnie bardzo rzadko stosowaną metodą leczenia – w związku z wprowadzeniem nowoczesnych terapii, takich jak przeciwciała bispecyficzne oraz komórki CAR-T.
LECZENIE CHŁONIAKÓW STREFY BRZEŻNEJ
LECZENIE I LINII CHŁONIAKA ŚLEDZIONOWEGO STREFY BRZEŻNEJ
U pacjentów chorych na śledzionowego chłoniaka strefy brzeżnej, ale również na inne podtypy chłoniaków strefy brzeżnej, u których stwierdza się wirusowe zapalenie wątroby typu C, leczenie rozpoczyna się od leczenia z wykorzystaniem tzw. bezpośrednich leków antywirusowych.
W tych przypadkach leczenie prowadzone jest przez lekarzy chorób zakaźnych lub hepatologów. Skuteczna eradykacja wirusa zapalenia wątroby typu C pozwala u większości pacjentów uzyskać ustąpienie objawów chłoniaka.
W pozostałych przypadkach konieczne jest zastosowanie leczenia ukierunkowanego bezpośrednio na chłoniaka.
Monoterapia z rytuksymabem, którą czasem pro-ponuje się pacjentom z małą masą guza, to zwy-kle 4 dawki podawane w odstępie tygodnia, z na-stępowym leczeniem podtrzymującym (dawki le-ku co 2-3 miesiące w kolejnych 2 latach).
W przeszłości podstawowym sposobem leczenia śledzionowego chłoniaka strefy brzeżnej było wykonanie splenektomii, czyli zabiegu usunięcia śledziony. Obecnie zabieg jest wykonywany znacznie rzadziej, zaś w leczeniu pierwszej linii stosuje się głównie rytuksymab, czyli przeciwciało monoklonalne skierowane przeciwko cząsteczce CD20.
W przypadku kwalifikacji do splenektomii koniecznie należy wykonać niezbędne szczepienia
W przypadku planowej splenektomii szczepienia ochronne powinny być wykonane minimum 2 tygodnie przed zabiegiem, zaś w przypadku nagłej splenektomii szczepienia powinny się rozpocząć przed upływem tygodnia po zabiegu.
Standardowo wykonuje się szczepienia przeciwko pneumokokom (Streptococcus pneum-oniae), meningokokom (Neisseria meningitidis) i Haemophilus influenzae typowi B (HiB).
Przykładowo cykl szczepień może obejmować: szczepionkę PCV13 (Prevenar®) i następnie po 8 tygodniach PPSV23 (Pneumovax 23®), jedną dawkę szczepionki przeciwko HiB np. Hiberix®, 2 dawki szczepionki przeciwko meningokokom serotypom ACWY np. Nimenrix® i 1-2 dawki szczepionki przeciwko meningokokom serotypowi B (Bex-sero®). Od niedawna dostępna jest na rynku rów-nież szczepionka skoniugowana 20-walentna przeciwko pneumokokom PCV20 (Ape-xxnar®).
W przypadku zastosowania szczepionki PCV20 najczęściej nie stosuje się następnie szczepionki PPSV23. U pacjentów po splenektomii konieczne są coroczne szczepienia przeciwko grypie.
Rytuksymab stosowany jest w monoterapii, co oznacza, że nie stosujemy innych leków przeciwchłoniakowych w tym samym czasie.
Najczęściej podaje się od 4 do 6 dawek leków w odstępach tygodniowych. Możliwe jest zastosowanie leczenia podtrzymującego po zakończonym leczeniu podstawowym (indukcyjnym) – wtedy lek podaje się raz na 8 tygodni.
Zastosowanie takiego przedłużonego leczenia nie przekłada się jednak na wydłużenie przeżycia, w związku z czym nie jest to postępowanie obligatoryjne i decyzja odnośnie takiego prze-dłużonego leczenia będzie podejmowana indywidualnie w każdym przypadku.
U części pacjentów może być konieczne zastosowanie leczenia immunochemioterapią (R-CVP, R-CHOP, R-Bendamustyna), ewentualnie protokołu R2.
Leczenie tymi protokołami opisano w części dotyczącej leczenia chłoniaka grudkowego – PRZEJDŹ!
Począwszy od drugiej linii leczenia możliwe jest (aczkolwiek w momencie pisania tego poradnika nierefundowane) leczenie z wykorzystaniem zanubrutynibu, który opiszemy dalej.
LECZENIE I LINII WĘZŁOWEGO CHŁONIAKA STREFY BRZEŻNEJ
Leczenie węzłowego chłoniaka strefy brzeżnej w dużej mierze przypomina leczenie chłoniaka grudkowego opisane wyżej. Są jednak pewne odrębności, które wymieniono poniżej.
- W leczeniu chłoniaka węzłowego strefy brzeżnej nie stosuje się obinutuzumabu. Jedynym stosowanym przeciwciałem monoklonalnym jest rytuksymab.
- W przypadku stosowania protokołu R-Bendamustyna możliwe jest skrócenie czasu leczenia do 4 cykli immunochemioterapii. Zasada ta obowiązuje dla wszystkich chłoniaków strefy brzeżne
- W przypadku opornego/nawrotowego chłoniaka strefy brzeżnej u pacjentów, którzy wcześniej stosowali co najmniej jedną terapię z zastosowaniem przeciwciał anty-CD20 możliwe jest leczenie zanubrutynibem. Jest to jedyny inhibitor kinazy Brutona posiadający takie wskazanie w Unii Europejskiej. W Polsce proces refundacyjny jest na ostatniej prostej. Spodziewamy się, że lek będzie dostępny dla pacjentów do końca 2024 roku.
- W leczeniu chłoniaka strefy brzeżnej nie stosuje się terapii CAR-T.
- W leczeniu chłoniaka strefy brzeżnej nie stosuje się mosunetuzumabu.
- Przeszczepienie autologicznych komórek krwiotwórczych w dalszym ciągu ma znaczenie u dobrze wyselekcjonowanych pacjentów.
LECZENIE I LINII POZAWĘZŁOWYCH CHŁONIAKÓW STREFY BRZEŻNEJ TYPU MALT
Leczenie pozawęzłowych chłoniaków strefy brzeżnej typu MALT jest najbardziej „nietypowym” leczeniem w całej hematoonkologii. W wielu przypadkach stosuje się leczenie przeciwdrobnoustrojowe, które pozwala na uzyskanie regresji chłoniaka.
Dzieje się tak dlatego, że w pierwszych etapach rozwoju chłoniaka MALT wzrost komórek nowotworowych zależy od cytokin wytwarzanych przez komórki układu immunologicznego tworzących naciek zapalny. Infekcja powoduje powstanie nacieku zapalnego podtrzymującego rozwój chłoniaka. Wyleczenie infekcji, czyli tym samym cofnięcie się nacieku zapalnego, może doprowadzić do regresji chłoniaka. Niestety w późniejszych stadiach rozwoju chłoniaka jego komórki zyskują pełną autonomię (niezależność) od nacieku zapalnego, a wyleczenie infekcji przestaje być wystarczające.
Monoterapia z rytuksymabem, którą czasem pro-ponuje się pacjentom z małą masą guza, to zwy-kle 4 dawki podawane w odstępie tygodnia, z na-stępowym leczeniem podtrzymującym (dawki le-ku co 2-3 miesiące w kolejnych 2 latach).
U pacjentów, u których zostanie rozpoznany chłoniak strefy brzeżnej typu MALT żołądka tzw. eradykacja bakterii Helicobacter pylori może być przeprowadzona jako jedyne leczenie.
Jest to postępowanie mające na celu eliminację bakterii. Helicobacter pylori jest spiralną bakterią wyposażoną w specjalne wici, dzięki którym może wnikać pod warstwę śluzu pokrywającego komórki nabłonkowe żołądka. Jest najczęstszą przyczyną wrzodów żołądka lub dwunastnicy. Wywołuje ponadto zapalenie błony śluzowej żołądka. W przypadku długo utrzymującego się stanu zapalnego może doprowadzać do rozwoju chłoniaków żołądka, w tym chłoniaków strefy brzeżnej typu MALT.
Sposób eliminacji bakterii może się różnić w zależności od preferencji pacjenta, doświadczenia lekarza oraz możliwości wykonania i wyniku badania lekooporności. Zawsze wymaga jednak równoczesnego stosowania inhi-bitora pompy protonowej wraz z zestawem najczęściej 3 różnych antybiotyków (np. amoksycyliny, metronidazolu i klarytromycyny lub metronidazolu, tetracykliny i bizmutu).
Będziemy też brać pod uwagę, czy byłeś wcześniej leczony z powodu zakażenia Helicobacter pylori, czy też jest to pierwsza próba leczenia. W opiekę nad Tobą będzie zaangażowany gastroenterolog. Po zakończonej eradykacji zostanie wykonana ocena skuteczności leczenia po 4-8 tygodniach.
Na tym etapie leczenia rzadko rekomenduje się leczenie systemowe chłoniaka. Sama eradykacja H. pylori pozwala na uzyskanie zadowalającej odpowiedzi nawet u 75 % chorych. Takie postępowanie wymaga jednak cierpliwości i spokojnego oczekiwania na odpowiedź. Czas do odpowiedzi chłoniaka na leczenie eradykujące jest wydłużony i trwa od kilku tygodni do nawet ponad roku. Z tego względu przyjmuje się co najmniej 12-miesięczny okres nadzoru endoskopowego przed rozpoznaniem opornego chłoniaka strefy brzeżnej żołądka.
Również w przypadku innych zlokalizowanych chłoniaków strefy brzeżnej, które mogą się wiązać z określonymi zakażeniami, stosuje się leczenie przeciwdrobnoustrojowe. Poniżej przedstawiono najczęstsze przykłady:
- Chłoniak strefy brzeżnej przydatków oka – doksycyklina lub klarytromycyna.
- Pierwotnie skórny chłoniak strefy brzeżnej – ceftriakson.
- Chłoniak strefy brzeżnej jelita – tetracyklina, metronidazol, ampicilina.
Istnieją różne sposoby dawkowania leków. W przypadku chłoniaków przydatków oka jeden ze sposobów stosowania doksycykliny obejmuje podawanie leku w dawce 2 x 100 mg/dobę przez okres 4 tygodni, następnie przez 4 tygodnie pacjent pozostaje bez leczenia, a cały proces terapeutyczny składa się łącznie z 3 dwumiesięcznych cykli. Należy pamiętać, że wymienione powyżej przykłady nie wyczerpują możliwości zastosowania leczenia przeciwdrobnoustroujowego w leczeniu chłoniaków strefy brzeżnej.
Gdy chłoniak nie ulega regresji po podaniu antybiotyków lub w razie konieczności uzyskania szybkiego efektu leczenia (np. ryzyko utraty lub pogorszenia się wzroku) stosuje się miejscową radioterapię lub immunochemioterapię, podob-ną do tej zalecanej w chłoniaku grudkowym, z tą różnicą, że obinutuzumab zastępujemy rytuksymabem.
Gdy chłoniak nie ulega regresji po podaniu antybiotyków lub w razie konieczności uzyskania szybkiego efektu leczenia (np. ryzyko utraty lub pogorszenia się wzroku) stosuje się miejscową radioterapię lub immunochemioterapię, podobną do tej zalecanej w chłoniaku grudkowym, z tą różnicą, że obinutuzumab zastępujemy rytuksymabem.
LECZENIE WZNOWY/OPORNOŚCI CHŁONIAKÓW STREFY BRZEŻNEJ
Jak już wspomniano, w przypadku nawrotu chłoniaka strefy brzeżnej zawsze konieczna jest weryfikacja histologiczna w celu wykluczenia transformacji do bardziej agresywnego chłoniaka.
Decyzja odnośnie wyboru określonego sposobu postępowania zależy od wielu czynników, w tym rodzaju wcześniejszego leczenia, czasu utrzymywania się odpowiedzi na poprzednie leczenie (w tym POD24, czyli wznowa występująca w ciągu 24 miesięcy od rozpoczęcia leczenia), stanu sprawności i chorób współistniejących.
Nie każdy nawrót wymaga leczenia. Jeżeli jest to jednak konieczne, mamy możliwość zastoso-wania: radioterapii, rytuksymabu w monoterapii, immunochemioterapii, protokołu R2 czy zanu-brutynibu, który podaje się doustnie, w 1-2 dawkach dziennie, do czasu progresji choroby lub pojawienia się efektów działań niepożądanych.
W związku z faktem, że ścieżki leczenia są ba-dzo indywidualne, porównywanie swojego leczenia do leczenia innego pacjenta z chłoniakiem strefy brzeżnej nie jest celowe i może pro-wadzić do niepotrzebnych nieporozumień.
W przypadku, w którym dochodzi do transformacji do bardziej agresywnego chłoniaka, leczenie przebiega podobnie jak u pacjentów chorych na chłoniaki agresywne.
LECZENIE MAKROGLOBULINEMII WALDENSTRÖMA
LECZENIE I LINII MW
W ostatnim czasie zmieniło się podejście do leczenia makroglobulinemii Waldenströma, co wynika z wprowadzenia nowych leków.
Niewykluczone, że do tej pory Twoje leczenie obejmowało protokoły, które nie są już rekomendowane, choć w przeszłości ich stosowanie było zgodne ze standardem leczenia. Obecnie w leczeniu makroglobulinemi Waldenströma bardzo rzadko rekomenduje się schematy immunochemio-terapii takie jak R-CHOP (rytuksymab, cyklofosfamid, doksorubicyna, winkrystyna, prednizon) czy R-CVP (rytuksymab, cyklofosfamid, winkrystyna, prednizon), które stosujemy nadal m.in. w leczeniu chłoniaka grudkowego czy chłoniaków strefy brzeżnej.
Podobnie, jak w przypadku omawianych wyżej chłoniaków - tj. chłoniaka grudkowego i chłoniaków strefy brzeżnej, leczenie makroglobulinemii Waldenströma rozpoczyna się dopiero po wystąpieniu charakterystycznych objawów lub upośledzenia funkcji twojego szpiku. Pełną listę wskazań do rozpoczęcia leczenia znajdziesz na s.40. Do tego czasu będziesz poddany jedynie regularnej obserwacji.
Częstotliwość monitorowania każdego pacjenta jest ustalana indywidualnie - wizyty odbywają się pomiędzy raz na 2 lub 3 miesiące do raz na rok. Schemat wizyt ustala lekarz prowadzący w oparciu o swoje doświadczenie i wybrane parametry laboratoryjne.
Monoterapia z rytuksymabem, którą czasem pro-ponuje się pacjentom z małą masą guza, to zwy-kle 4 dawki podawane w odstępie tygodnia, z na-stępowym leczeniem podtrzymującym (dawki le-ku co 2-3 miesiące w kolejnych 2 latach).
W przypadku, gdy konieczne będzie włączenie leczenia, w większości przypadków zaproponujemy immunochemioterapię, która jest połączeniem dwóch metod – immunoterapii, wykorzystującej mechanizmy immunologiczne oraz klasycznej chemioterapii.
RCD | RB
Rekomendacje międzynarodowe wskazują dwa podstawowe protokoły chemioimmunoterapii do stosowania u pacjentów chorych na makro-globulinemię Waldenströma: RCD (rytuksymab,cyklofosfamid, deksametazon) oraz RB (rytuksymab – bendamustyna).
Obydwa protokoły są dobrze tolerowane, w tym również przez osoby starsze czy osoby z chorobami współistniejącymi. Immunochemioterapia jest leczeniem ograniczonym w czasie, co daje możliwość prowadzenia zwykłego życia po jej zakończeniu.
Najczęściej stosuje się 6 cykli leczenia, aczkolwiek w indywidualnych przypadkach możliwe jest ich skrócenie do 4 cykli i/lub zmniejszenie dawki cytostatyków, co zwłaszcza dotyczy bendamustyny.
Po zakończonym leczeniu indukcyjnym nie stosujemy standardowo tzw. leczenia podtrzymującego z rytuksymabem. Może się jednak zdarzyć, że zaproponujemy je chorym z wysokim ryzykiem.
BORTEZOMIB
W przypadkach, gdzie makroglobulinemii Waldenströma towarzyszy amyloidoza łańcuchów lekkich, podstawę stosowanych protokołów immunochemioterapii stanowią tzw. inhibitory proteasomu np. bortezomib.
Od niedawna alternatywę dla immunochemioterapii stanowi zastosowanie inhibitorów kinazy tyrozynowej Brutona, zaliczanych do grupy tzw. leków celowanych.
W Polsce, w pierwszej linii leczenia zanubrutynib jest refundowany u pacjentów, którzy nie kwalifikują się do immunochemioterapii np. z powodu chorób współistniejących lub ogólnej „kruchości”.
W przypadkach, gdzie makroglobulinemii Waldenströma towarzyszy amyloidoza łańcuchów lekkich, podstawę stosowanych protokołów immunochemioterapii stanowią tzw. inhibitory proteasomu np. bortezomib.
Ważnym elementem leczenia wspomagającego, stosowanym czasami u pacjentów chorych na makroglobulinemię Waldenströma, jest plazmafereza. Celem zabiegu jest szybkie usunięcie z osocza określonych białek lub tłuszczów, w tym białka IgM, które jest bezpośrednio odpowiedzialne za szereg objawów choroby.
Plazmaferezy proponujemy pacjentom z objawami zespołu nadlepkości, gdy stężenie białka IgM jest za wysokie.
Objawy zespołu nadlepkości to uogólnione osłabienie, zawroty głowy, bóle głowy, zaburzenia widzenia (pogorszenie ostrości wzroku), upośledzenie słuchu, krwawienia z jamy nosowo-gardłowej, zaburzenia równowagi, ataksja; w przypadkach ostrego zespołu nadlepkości: zaburzenia świadomości, otępienie, encefalopatia, śpiączka.
LECZENIE WZNOWY/OPORNOŚCI MW
Podobnie, jak chłoniak grudkowy czy chłoniak strefy brzeżnej, również makroglobulinemia Waldenströma charakteryzuje się nawrotowym charakterem. Co istotne, nie każdy nawrót musi wymagać leczenia, ewentualne rozpoczęcie leczenia może być odroczone w czasie.
W przypadku kwalifikacji do leczenia kluczowe, w kontekście wyboru terapii, jest pytanie, czym pacjent był wcześniej leczony i z jakim skutkiem.
Monoterapia z rytuksymabem, którą czasem pro-ponuje się pacjentom z małą masą guza, to zwy-kle 4 dawki podawane w odstępie tygodnia, z na-stępowym leczeniem podtrzymującym (dawki le-ku co 2-3 miesiące w kolejnych 2 latach).
Jeżeli pacjent nie otrzymywał wcześniej inhibitorów kinazy tyrozynowej Brutona, możliwe jest zastosowanie zanubrutynibu (od II linii leczenia refundowany przez NFZ u wszystkich chorych).
Alternatywą dla leków celowanych jest zastosowanie immunochemioterapii. Wybór określonego protokołu zależy również od tego, czym pacjent był wcześniej leczony, z jakim skutkiem, jakie ma choroby współistniejące, w jakim jest stanie ogólnym.
Zasadniczo możliwe jest zastosowanie protokołów wymienionych wcześniej, tj. RCD, R-Bendamustyna, ale również protokołów zawierających inhibitory proteasomów, np. bortezomib, czyli leków stosowanych powszechnie w leczeniu szpiczaka plazmocytowego.
Największym wyzwaniem w chwili obecnej wydaje się leczenie pacjentów, którzy byli uprzednio leczeni zarówno immunochemioterapią, jak i inhibitorami kinazy tyrozynowej Brutona.
Dla tych pacjentów rekomendacje międzynarodowe wska-zują takie opcje terapeutyczne jak pirtobrutynib (nowy, niekowalencyjny inhibitor kinazy tyrozynowej Brutona), wenetoklaks czy nowe przeciwciała anty-CD20.
Warto jednak zaznaczyć, że żadna z tych opcji nie ma rejestracji do leczenia makroglobulinemii Waldenströma w Unii Europejskiej. W tych sytuacjach warte jest rozważenie leczenia w ramach badań klinicznych – zawsze zapytaj lekarza o taką możliwość.
Alternatywą pozostaje zatem intensywniejsza immunochemioterapia lub przeszczepienie autologicznych komórek krwiotwórczych u młodszych pacjentów, w dobrym stanie ogólnym, co jest możliwe po potwierdzeniu wrażliwości choroby na chemioterapię ratunkową.
OCENA ODPOWIEDZI NA LECZENIE
- Warto zwrócić uwagę na fakt, że leczenie chłoniaków indolentnych opisanych w poradniku różni się znacznie od leczenia chłoniaków o przebiegu agresywnym. Podczas, gdy celem leczenia w przypadku chłoniaków o przebiegu agresywnym jest tylko odpowiedź całkowita, w przypadku chłoniaków indolentnych niejednokrotnie wystarcza uzyskanie odpowiedzi częściowej.
- Większość pacjentów po zakończonym leczeniu przez wiele lat nie będzie musiała podejmować kolejnej terapii.
- Monitorowanie okresu remisji jest zawsze indywidualnie ustalane z lekarzem/ośrodkiem prowadzącym.
Monoterapia z rytuksymabem, którą czasem pro-ponuje się pacjentom z małą masą guza, to zwy-kle 4 dawki podawane w odstępie tygodnia, z na-stępowym leczeniem podtrzymującym (dawki le-ku co 2-3 miesiące w kolejnych 2 latach).
W przypadku chłoniaka grudkowego i chłoniaków strefy brzeżnej posługujemy się kryteriami oceny odpowiedzi z Lugano, zgodnie z którymi rozpoznajemy:
- CR remisję całkowitą
- PR remisję częściową
- SD brak odpowiedzi/stabilizację choroby
- PD progresję choroby
Jeżeli ocena jest wykonywana z wykorzystaniem badania PET-TK, mówimy o tzw. metabolicznej odpowiedzi, dodając przedrostek „m” do skrótów.
U pacjentów leczonych z powodu makroglobulinemii Waldenströma posługujemy się kryteriami odpowiedzi zaproponowanymi przez IWWM-11 (11th International Workshop on Waldenström’s Macroglobulinemia):
CR odpowiedź całkowita
- niewykrywalne białko monoklonalne w elektroforezie i oceniane badaniem immunofiksacji
- IgM w zakresie normy
- szpik bez nacieku komórkami chłoniaka LPL
- nieobecność choroby pozaszpikowej, o ile była stwierdzana wyjściowo
VGPR bardzo dobra odpowiedź częściowa
- ≥90% redukcja stężenia w surowicy białka IgM lub białko IgM w zakresie normy
PR odpowiedź częściowa
- redukcja stężenia białka IgM o ≥50% i <90%
PR mniejsza odpowiedź
- redukcja stężenia białka IgMo ≥25% i <50%
SD stabilna choroba
- redukcja stężenia białka IgM o <25% lub wzrost stężenia o <25%
PD progresja choroby
- wzrost stężenia IgM o ≥25% i co najmniej o 500 mg/dL w stosunku do najmniejszej wartości
- konieczne jest potwierdzenie PD w drugim badaniu
- PD można również rozpoznać w badaniach obrazowych (pojawienie się nowej zmiany >1,5 cm lub powiększenie wymiarów stwierdzanej wcześniej zmiany >50% do >1,5 cm)
W ocenie skuteczności leczenia posługujemy się również sformułowaniem „większa odpowiedź”, które oznacza sumę odpowiedzi tj. CR + VGPR + PR.
PRAKTYCZNIE O LECZENIU
PRAKTYCZNIE O CHEMIOTERAPII na co się przygotować
W przypadku chłoniaka grudkowego w I, ewentualnie II stadium zaawansowania klinicznego, ale wtedy, kiedy węzły chłonne są położone blisko siebie, a ich wymiary nie są duże, można podjąć decyzję o kwalifikacji do radio-terapii, mając nadzieję, że będzie to leczenie radykalne (tzn. pozwoli na wyleczenie chłoniaka). Konieczne jest jednak wykluczenie nawet minimalnego zajęcia szpiku, co w praktyce jest bardzo trudne.
W zaawansowanym stadium klinicznym chłoniaka grudkowego posługujemy się tzw. kryteriami GELF (Groupe d’Etude des Lymphomes Folliculaires Criteria). Rozpoczęcie leczenia rekomenduje się u osób, u których można stwierdzić co najmniej jedną z poniższych sytuacji:
1. Zajęcie co najmniej 3 lokalizacji węzłowych, każda >3 cm średnicy
2. Objawy ucisku na istotne narządy
3. Obecność jakiejkolwiek zmiany >7 cm średnicy
4. Obecność objawów B tj. gorączki lub nocnych potów lub utraty masy ciała
5. Powiększenie śledziony poniżej linii pępka
6. Wysięk (płyn) w opłucnej lub otrzewnej
7. NEUTROPENIA (Obniżenie liczby NEUTROFILÓW <1 x 109/L), małopłytkowość (liczba płytek krwi <100 x 109/L) wynikające z zajęcia szpiku
8. Faza białaczkowa chłoniaka (>5 x109/L limfocytów chłoniaka grudkowego we krwi obwodowej)
Tymi samymi kryteriami posługujemy się również w przypadku węzłowych chłoniaków strefy brzeżnej.
Każdy schemat leczenia zakłada podawanie kolejnych cykli co pewien określony czas – najczęściej co 3 lub 4 tygodnie.
- Jeżeli w tym czasie masz infekcję lub nastąpiło istotne pogorszenie stanu zdrowia z powodu chorób towarzyszących, zawsze poinformuj o tym wcześniej lekarza prowadzącego.
- Po sprawdzeniu wyników badań krwi, rozmowie i badaniu, lekarz zleci lub odroczy podanie kolejnego cyklu chemioterapii. Chemioterapię odracza się, jeśli jej podanie jest obarczone dla chorego większym ryzykiem niż opóź-nienie podania. Może to wynikać z Twoich badań krwi, aktualnego stanu zdrowia ogólnego lub sytuacji epidemiologicznej na oddziale. Jeśli masz wątpliwości co do takiej decyzji, zawsze dopytaj lekarza, aby Ci wytłumaczył, dlaczego zapadła decyzja o odroczeniu leczenia.
- Badania krwi można wykonać w ośrodku prowadzącym lub we własnym zakresie zgodnie ze wskazówkami lekarza.
- Od zlecenia do przygotowania w aptece Twoich leków przeciwnowotworowych mija pewien czas. Podanie leków, zwłaszcza jeżeli wymaga kroplówek (wlewów dożylnych), również trwa. Należy przygotować się na wielogodzinny pobyt w oddziale dziennym lub liczyć z perspektywą krótkiej hospitalizacji.
W schematach leczenia o dużym ryzyku tzw. gorączki neutropenicznej lub neutropenii (obniżenia się liczby neutrofili, inaczej nazwanych granulocytami), stosuje się jako tzw. profilaktykę pierwotną czynnikami wzrostu granulocytów, które pobudzają szpik, powodując jego szybszą regenerację.
- Leki te (Zarzio®, Accofil®, Tevagrastim®) podaje się podskórnie, zwykle wieczorem przez 5-7 dni, rozpoczynając 24-72 godziny po zakończeniu podawania cytostatyków.
- Należy pamiętać, że bezwzględnie konieczne jest zakończenie ich stosowania, co najmniej na 48 h przed kolejną dawką chemioterapii.
- Czynniki wzrostu granulocytów podane bezpośrednio przed chemioterapią zwiększają ryzyko uszkodzenia przez cytostatyki prawidłowych komórek krwiotwórczych szpiku, co zmniejsza jego rezerwy i może upośledzać jego działanie w przyszłości.
- Po podaniu czynników wzrostu granulocytów może wystąpić krótkotrwała gorączka wymagająca podania paracetamolu (np. 2 tbl po 500 mg).
- U niektórych pacjentów po kilku dniach stosowania czynników wzrostu pojawią się nasilone objawy „rzekomogrypowe” (bóle głowy, kości, mięśni gorączka). Jest to wyraz regeneracji układu granulocytotwórczego. W takich przypadkach należy wykonać kontrolę morfologii, a przy wzroście liczby granulocytów powyżej 2000 przerwać podawanie kolejnych dawek czyn-ników wzrostu.
- W onkologii stosuje się także tzw. długodziałające czynniki wzrostu granulocytów (np. Neulasta®), których 1 dawka działa przez kolejne 10-14 dni. W leczeniu chłoniaków, gdy zależy nam na bardziej skrupulatnej kontroli, leki te są rzadko rekomendowane.
- Warto wspomnieć, że w przypadku leków stosowanych w sposób długotrwały lub ciągły (np. lenalidomid, zanubrutynib, wenetoklaks) niejednokrotnie stosuje się równocześnie czynnik wzrostu granulocytów i lek przeciwnowotworowy.
Rzadziej mamy do czynienia z niedokrwistością i małopłytkowością. W przypadkach niedokrwistości można stosować erytropoetynę, która jest czynnikiem wzrostu dla erytrocytów.
Przy dużym obniżeniu stężenia hemoglobiny rozważa się przetaczanie krwi (koncentratu krwinek czerwonych). Przetoczenia wykonuje się w trakcie hospitalizacji, wymagają one oznaczenia grupy krwi albo oryginalnego dokumentu potwierdzającego wynik grupy krwi i każdorazowo wykonania tzw. „próby zgodności”.
Każdy epizod gorączki niezwiązany bezpośrednio z podaniem czynników wzrostu, zwłaszcza gdy towarzyszą mu inne objawy infekcji, wymaga pilnej kontroli morfologii i konsultacji lekarza (w godzinach wieczornych w ramach Szpitalnego Oddziału Ratunkowego) w celu ustalenia wskazań do rozpoczęcia antybiotykoterapii.
W razie infekcji, której towarzyszy agranulocytoza, tzn. gdy liczba neutrofii spada poniżej <0,5 x 109/L, antybiotyki powinno się podawać dożylnie, w warunkach szpitalnych.
Pamiętaj, by w każdym przypadku infekcji COVID-19, powiadomić o tym prowadzącego hematologa/onkologa. Chociaż czas pandemii mamy już za sobą, COVID-19 wiąże się nadal z dużym ryzykiem dla pacjentów chorych na chłoniaki w czasie leczenia.
Leki zalecone przez innych lekarzy z powodu wcześniej stwierdzonych chorób należy nadal przyjmować. Jednak o stosowanych lekach i każdej zmianie ich dawkowania musi być poinformowany lekarz prowadzący.
W niektórych przypadkach zaleca się dodatkowo niektóre leki profilaktycznie, takie jak np. acyklowir (np. Heviran®, Hascovir® – profilaktyka niektórych infekcji wirusowych) czy kotrymoksazol (np. Biseptol® – profilaktyka groźnego zapalenia płuc Pneumocystis jiroveci).
Suplementy diety i zioła mogą natomiast „zakłócić” działanie chemioterapii, np. wpływając na wchłanianie niektórych leków z przewodu pokarmowego, stąd odradzamy ich przyjmowanie w trakcie leczenia bez wcześniejszej konsultacji z lekarzem.
Sterydy są często stosowane jako jeden z elementów schematów chemioterapii. W schematach R-CHOP/ O-CHOP czy R-CVP/ O-CVP Encorton stosowany jest doustnie przez okres 5 dni, czyli również już po wypisaniu z oddziału/dziennego ośrodka leczenia.
Lek zażywamy po posiłku, w dawkach podzielonych, 2/3 dawki po śniadaniu, 1/3 dawki po obiedzie.
W wybranych sytuacjach zwiększonego ryzyka wystąpienia choroby wrzodowej żołądka dodatkowo zaleca się stosowanie leków zmniejszających wydzielanie kwasu żołądkowego, zwykle blokerów pompy protonowej (omeprazol, pantoprazol, esomeprazol). Leki te stosujemy pół godziny przed śniadaniem i w razie potrzeby drugą dawkę po kolacji. Pozostałe najczęstsze efekty działania niepożądanego sterydów i zalecenia podsumowano w tabeli na kolejnej stronie.
Częstym błędem jest pomijanie dawki sterydów w 1 dniu cyklu chemioterapii, czyli wtedy, gdy jest to najbardziej potrzebne. Może się tak zdarzyć w dziennym ośrodku leczenia, gdy pielęgniarka jest przekonana, że lek zażył sam pacjent, a ten oczekuje, że wszystkie leki poda mu personel.
Nagłe odstawienie sterydów jest przez część chorych źle tolerowane (uczucie braku energii, zawroty głowy) – wówczas powinno się rozważyć stopniową redukcję dawki, czyli np. podanie jednej dodatkowej dawki (np. 20 mg Encortonu) rano w pierwszym dniu po ich odstawieniu lub tzw. suplementacyjnych dawek hydrokortyzonu.
Sterydy zwiększają apetyt i prowadzą do wzrostu masy ciała. U pacjentów z objawami ogólnymi i znacznym spadkiem masy ciała przed rozpoczęciem leczenia jest to akceptowalne (a nawet pożądane), jednak osoby z nadwagą czy otyłością powinny w trakcie sterydoterapii zwrócić szczególną uwagę na dietę, ograniczać spożycie cukrów prostych i tłuszczów.
Kontrola masy ciała ma szczególne znaczenie w przypadku leczenia schematami chemioterapii zawierającymi antracykliny, np. R-CHOP/O-CHOP, które dodatkowo mogą upośledzać czynność serca, aby nie obciążać nadmiernie wydolności serca nadwagą.
Najczęstsze efekty działania niepożądanego sterydów, ich szczegóły i ewentualnie zalecenia:
Uszkodzenie błony śluzowej żołądka:
- Zażywanie sterydów po posiłkach.
- Stosowanie blokerów pompy protonowej (omeprazol, pantoprazol, esomeprazol itp.)
Wzrost poziomu cukru we krwi:
- U pacjentów chorujących na cukrzycę, jeszcze przed rozpoczęciem sterydoterapii, może zachodzić konieczność modyfikacji jej leczenia, np. okresowa zmiana dawek insuliny w trakcie stosowania sterydów.
- U części chorych zachodzi konieczność leczenia tzw. „cukrzycy posterydowej”.
- UWAGA: bagatelizowanie problemu („jakoś to będzie”) może zwiększyć ryzyko infekcji, które są częstsze u chorych ze źle kontrolowanym poziomem cukru we krwi.
Wzrost ciśnienia tętniczego krwi:
U części chorych konieczność rozpoczęcia lub modyfikacji leczenia nadciśnienia tętniczego.
Upośledzenie czynności układu immunologicznego:
- Sterydy mogą podwyższać liczbę granulocytów poprzez mobilizację ich z puli tzw. przyściennej, co przekłada się na wzrost liczby wszystkich leukocytów. Jest to zjawisko oczekiwane, niewywołujące niepokoju.
- Sterydy mogą obniżać liczbę limfocytów, upośledzają funkcję limfocytów, działając synergistycznie z cytostatykami i przeciwciałami monoklonalnymi.
Upośledzenie regeneracji tkanki łącznej:
Upośledzenie gojenia się ran, zrastania się złamań.
Zaburzenia nastroju:
U starszych osób podawanie, w gruncie rzeczy, wysokich dawek sterydów może doprowadzać do nieadekwatnego zachowania, w skrajnych przypadkach do tzw. „psychozy posterydowej”.
Zaburzenia snu:
Stosowanie sterydów oraz napięcie emocjonalne wynikające z choroby i leczenia mogą nasilać problemy ze snem – w skrajnych przypadkach doprowadzają do skrajnej bezsenności.
Osteoporoza:
Stosowanie sterydów jako elementu schematów chemioterapii jest okresowe, stąd nie ma dużego ryzyka odległych skutków działań niepożądanych.
Obecne leki przeciwwymiotne są na tyle efektywne, że nudności zdarzają się jedynie w pojedynczych przypadkach.
Oczywiście pod warunkiem ich stosowania w dniu chemioterapii i – w razie potrzeby – przez kilka dni po jej zakończeniu (w przypadku protokołów o tzw. wysokim potencjale emetogennym – z reguły przez 3-4 dni).
Najczęściej stosowanym lekiem jest ondansetron, który można podawać dożylnie, razem z cytostatykami. W domu stosuje się go doustnie w dawce 1 do 3 tbl dziennie, w zależności od potrzeby.
Innymi lekami, które mogą być stosowane w profilaktyce wymiotów, są aprepitant (stosowany przez 3 dni), jak również olanzapina – lek stosowany w psychiatrii, ale wykazujący bardzo silne działanie przeciwwymiotne.
Upewnij się, czy w czasie wizyty lekarskiej związanej z chemioterapią, lekarz przepisał ci sterydy, wszystkie leki osłonowe, w tym przeciwwymiotne, o ile ich potrzebujesz.
Większość schematów stosowanych w leczeniu chłoniaków indolentnych (poza R-CHOP/O-CHOP) nie doprowadza do masywnej utraty włosów.
W czasie trwania leczenia choroby nowotworowej należy stosować skuteczną metodę antykoncepcji: leki hormonalne, wkładkę wewnątrzmaciczną lub abstynencję seksualną.
Stosowanie wyłącznie prezerwatyw, bez dodatkowej antykoncepcji, nie daje wystarczającej pewności, a stosunek przerywany czy metody naturalne, oparte o „kalendarzyk” nie są uznawane za wiarygodne metody antykoncepcji i nie są zalecane. Zajście w ciążę w trakcie leczenia chłoniaka może wymusić zmianę planu leczenia i stanowić realne zagrożenie zarówno dla matki jak i płodu.
PRAKTYCZNIE O IMMUNOTERAPII na co się przygotować
W terapii chłoniaków indolentnych najczęściej stosuje się tzw. przeciwciała monoklonalne skierowane przeciwko cząsteczce CD20 obecnej na powierzchni limfocytów B, czyli rytuksymab lub - nowszy i potencjalnie skuteczniejszy - obinutuzumab.
O ile rytuksymab można podać w pełnej dawce już w pierwszym dniu leczenia, obinutuzumab - silniej aktywujący mechanizmy odpornościowe organizmu - wymaga podzielenia pierwszej dawki na dwie, podawane w kolejnych dniach po obowiązkowej „premedykacji” (patrz dalej). Jeszcze większe środki ostrożności podejmuje się w przypadku mosunetuzumabu, przeciwciała bispecyficznego, najsilniej pobudzającego nasz układ immunologiczny.
W przypadku chłoniaka grudkowego w I, ewentualnie II stadium zaawansowania klinicznego, ale wtedy, kiedy węzły chłonne są położone blisko siebie, a ich wymiary nie są duże, można podjąć decyzję o kwalifikacji do radio-terapii, mając nadzieję, że będzie to leczenie radykalne (tzn. pozwoli na wyleczenie chłoniaka). Konieczne jest jednak wykluczenie nawet minimalnego zajęcia szpiku, co w praktyce jest bardzo trudne.
W zaawansowanym stadium klinicznym chłoniaka grudkowego posługujemy się tzw. kryteriami GELF (Groupe d’Etude des Lymphomes Folliculaires Criteria). Rozpoczęcie leczenia rekomenduje się u osób, u których można stwierdzić co najmniej jedną z poniższych sytuacji:
1. Zajęcie co najmniej 3 lokalizacji węzłowych, każda >3 cm średnicy
2. Objawy ucisku na istotne narządy
3. Obecność jakiejkolwiek zmiany >7 cm średnicy
4. Obecność objawów B tj. gorączki lub nocnych potów lub utraty masy ciała
5. Powiększenie śledziony poniżej linii pępka
6. Wysięk (płyn) w opłucnej lub otrzewnej
7. NEUTROPENIA (Obniżenie liczby NEUTROFILÓW <1 x 109/L), małopłytkowość (liczba płytek krwi <100 x 109/L) wynikające z zajęcia szpiku
8. Faza białaczkowa chłoniaka (>5 x109/L limfocytów chłoniaka grudkowego we krwi obwodowej)
Tymi samymi kryteriami posługujemy się również w przypadku węzłowych chłoniaków strefy brzeżnej.
Największe ryzyko jest po pierwszej dawce, stąd podaje się ją w czasie krótkotrwałej hospitalizacji lub w warunkach ścisłego monitorowania w dziennym ośrodku leczenia.
Ich infuzja poprzedzona jest tzw. premedykacją, najczęściej ze sterydem, paracetamolem i lekiem przeciwhistaminowym, co może uniemożliwić kierowanie samochodem w tym dniu.
W przypadku wystąpienia reakcji alergicznych podaje się dodatkowe leki i wydłuża czas infuzji przeciwciał. Najczęstszymi klinicznymi objawami są gorączka, duszność, świąd lub zaczerwienie skóry, wzrost lub spadek ciśnienia krwi. Reakcje te nie występują w domu po zakończeniu podawania leku – już po wypisie ze szpitala.
Immunoterapia niszczy komórki nowotworowe, aktywując nasz własny układ immunologiczny, stąd można w jej trakcie odczuwać tzw. objawy rzekomogrypowe: gorączkę, bóle mięśni, głowy, uczucie zmęczenia. Bardziej nasilonych objawów można się spodziewać przy silniej działających przeciwciałach nowej generacji.
Przeciwciała bispecyficzne działają z taką siłą, że może to prowadzić, podobnie jak przy terapii CAR-T – do tzw. zespołu uwalniania cytokin. Jest to ogólnoustrojowa reakcja zapalna z powodu masowej aktywacji limfocytów z następowym uwalnianiem cytokin. Może dawać różne objawy – od łagodnych objawów rzekomogrypowych do ciężkich, zagrażających życiu, w tym przesiąkania włośniczek, rozsianego wykrzepiania wewnątrznaczyniowego, wstrząsu i niewydolności wielonarządowej. Objawy ze strony układu oddechowego obejmują spektrum od kaszlu i przyspieszonego oddechu po zespół ostrej niewydolności oddechowej. Dlatego do czasu upewnienia się,
że jesteś bezpieczny, pozostaniesz w szpitalu.
Przeciwciała monoklonalne rzadko prowadzą do neutropenii (obniżenia liczby neutrofilów), choć można się jej spodziewać, stosując je w skojarzeniu z chemioterapią. Przeciwciała monoklonalne upośledzają jednak w sposób istotny działanie układu immunologicznego, np. prowadząc do znacznego spadku wszystkich – w tym zdrowych – limfocytów B.
Niedobór limfocytów możemy stwierdzić na podstawie ogólnie obniżonej liczby limfocytów w badaniu morfologii – stwierdzenie niedoboru określonej subpopulacji limfocytów wymaga wykonania badania cytometrii przepływowej. Nie ma możliwości uzupełnienia niedoboru limfocytów. W przypadku niedoboru immunoglobulin, który może być wynikiem niedoboru limfocytów B możliwe jest przetoczenie poliklonalnych immunoglobulin. W przypadku niedoboru limfocytów T stosuje się jedynie odpowiednią profilaktykę p/infekcyjną. Nie należy stosować wyciągów z grasicy. Nie ma badań klinicznych potwierdzających ich skuteczność i bezpieczeństwo stosowania.
Jak wcześniej wspomniano, każda gorączka wymaga zawsze wykluczenia przyczyn infekcyjnych oraz wykonania badania morfologii. Infekcje u chorych z niską liczbą neutrofilów (neutropenią) czy wręcz agranulocytozą ( głęboką neutropenią – spadek neutrofilów <0,5 x 109/L) są potencjalnym zagrożeniem życia, należy je leczyć w warunkach szpitalnych, w trybie pilnym.
Pamiętaj, w razie wystąpienia gorączki powyżej 38 stopni w godzinach nocnych, należy udać się niezwłocznie do Szpitalnego Oddziału Ratunkowego – zwlekanie z wykonaniem badań i konsultacją lekarską do rana może prowadzić do rozwinięcia się sepsy, co stanowi bezpośrednie zagrożenie życia.
To jedna z najsilniej działających metod immunoterapii. Ich refundacja od 2024 roku u pacjentów z nawrotowym chłoniakiem grudkowym, po niepowodzeniu 2 lub więcej wcześniejszych linii leczenia, jest „kamieniem milowym”, stwarza wielką szansę i przywraca nadzieję.
Pacjenci muszą być przygotowani na możliwe skutki działań niepożądanych, w tym ryzyko wystąpienia opisanego wcześniej zespołu uwalniania cytokin. W celu zmniejszenia ryzyka mosunetuzumab podawany jest po adekwatnej premedykacji, a pierwsze 2 dawki są znacząco niższe. W charakterystyce produktu leczniczego zaleca się szczególną ostrożność, wręcz rozważenie obligatoryjnej hospitalizacji przy 3-cim podaniu leku, gdy po raz pierwszy podajemy pełną dawkę terapeutyczną. Nie oznacza to, że u części chorych nie obserwowaliśmy spektakularnych regresji choroby już po jego pierwszej dawce. Leczenie jest ograniczone w czasie, podajemy 8 cykli u chorych z całkowitą odpowiedzią, mając możliwość wydłużenia leczenia do 17 cykli u osób z częściową odpowiedzią.
Leczenie to, pod względem mechanizmu działania i skuteczności, można porównać to terapii CAR-T. Jego wielką zaletą jest możliwość podania go od razu, bez konieczności przygotowania limfocytów niezbędnych do terapii komórkowej.
Lenalidomid jest dość powszechnie stosowanym lekiem immunomodulującym. Najczęstszym efektem jego działań niepożądanych jest obniżenie liczby neutrofilów (stąd lek stosujemy w cyklach 14 lub 21 dniowych, po których zawsze następuje tygodniowa przerwa w jego podawaniu). Lenalidomid ma jednak silne działanie teratogenne, uszkadzające płód.
Działa on o wiele silniej od talidomidu, który był w latach 60-tych ubiegłego wieku przyczyną ogromu nieszczęść. Talidomid zalecano w ciąży, co pro-wadziło u części płodów do zahamowania tworzenia się zawiązków kończyn, tzw. fokomelii (dzieci rodziły się bez rąk i nóg). Dlatego lenalidomid jest przeciwwskazany u kobiet mogących zajść w ciążę, zaś w przypadku mężczyzn przyjmujących lenalidomid konieczne jest stosowanie pewnej metody anty-koncepcji i prezerwatywy w trakcie stosunku.
Niebezpieczeństwo jest tak duże, że zaleca się – w razie przygotowywania leków przez córkę lub wnuczkę chorego – by w ogóle nie dotykała tabletek bez rękawiczek.
Pacjenci, którym przepisuje się lek, muszą być odpowiednio przeszkoleni, by nie doszło do sytuacji zagubienia leku lub jego przypadkowego zażycia przez osoby trzecie.
W sytuacji, gdy dojdzie do zajścia w ciążę partnerki mężczyzny przyjmującego lenalidomid, rekomenduje się niezwłoczne poinformowanie o tym fakcie swojego lekarza prowadzącego, ponieważ powinna zostać skierowana do lekarza specjalizującego się lub mającego doświadczenie w zakresie teratologii (wad wrodzonych płodu).
W przypadku stosowania lenalidomidu lekarz prowadzący powinien zalecić również profilaktykę przeciwzakrzepową (np. tabletkę aspiryny) w celu zmniejszenia ryzyka wystąpienia powikłań zakrzepowo-zatorowych.
PRAKTYCZNIE O LEKACH CELOWANYCH (UKIERUNKOWANYCH MOLEKULARNIE) na co się przygotować
W przypadku chłoniaka grudkowego w I, ewentualnie II stadium zaawansowania klinicznego, ale wtedy, kiedy węzły chłonne są położone blisko siebie, a ich wymiary nie są duże, można podjąć decyzję o kwalifikacji do radio-terapii, mając nadzieję, że będzie to leczenie radykalne (tzn. pozwoli na wyleczenie chłoniaka). Konieczne jest jednak wykluczenie nawet minimalnego zajęcia szpiku, co w praktyce jest bardzo trudne.
W zaawansowanym stadium klinicznym chłoniaka grudkowego posługujemy się tzw. kryteriami GELF (Groupe d’Etude des Lymphomes Folliculaires Criteria). Rozpoczęcie leczenia rekomenduje się u osób, u których można stwierdzić co najmniej jedną z poniższych sytuacji:
1. Zajęcie co najmniej 3 lokalizacji węzłowych, każda >3 cm średnicy
2. Objawy ucisku na istotne narządy
3. Obecność jakiejkolwiek zmiany >7 cm średnicy
4. Obecność objawów B tj. gorączki lub nocnych potów lub utraty masy ciała
5. Powiększenie śledziony poniżej linii pępka
6. Wysięk (płyn) w opłucnej lub otrzewnej
7. NEUTROPENIA (Obniżenie liczby NEUTROFILÓW <1 x 109/L), małopłytkowość (liczba płytek krwi <100 x 109/L) wynikające z zajęcia szpiku
8. Faza białaczkowa chłoniaka (>5 x109/L limfocytów chłoniaka grudkowego we krwi obwodowej)
Tymi samymi kryteriami posługujemy się również w przypadku węzłowych chłoniaków strefy brzeżnej.
Tazemetostat jest tzw. inhibitorem EZH2, będącym metyltransferazą histonów i jest lekiem o udowodnionej skuteczności w leczeniu chłoniaka grudkowego. Mechanizm działania tazemetostatu jest dość skomplikowany.
W uproszczeniu można przyjąć, że odblokowuje różnicowanie limfocytów chłoniaka, równocześnie umożliwiając ich rozpoznanie i zabicie przez limfocyty T. Co ważne, tazemetostat działa zarówno u pacjentów z mutacjami w obrębie EZH2 jak i u pacjentów bez mutacji EZH2. Lek jest stosowany doustnie.
Leczenie jest dobrze tolerowane przez pacjentów, a poważne działania niepożądane występują u <5% chorych.
Tazemetostat, ze względu na unikalny mechanizm działania i praktyczny brak działań niepożądanych, jest idealnym lekiem do stosowania w skojarzeniu z immunoterapią. Trwają badania kliniczne nad znalezieniem optymalnego schematu – największe nadzieje budzi jego skojarzenie z schematem R2 (lenalidomidem i rytuksymabem).
Zanubrutynib jest inhibitorem kinazy tyrozynowej Brutona, które są zaliczane do grupy tzw. leków celowanych (ukierunkowanych molekularnie). Jest inhibitorem II generacji.
W Polsce może być stosowany w leczeniu pierwszej linii makroglobulinemii Waldenströma u pacjentów, którzy nie kwalifikują się do immunochemioterapii, np. z powodu chorób współistniejących lub ogólnej „kruchości” lub w drugiej i kolejnych liniach bez ograniczeń.
W odróżnieniu od immunochemioterapii zanubrutynib jest stosowany w sposób ciągły aż do czasu, kiedy albo dojdzie do progresji, albo wystąpią u Ciebie istotne działania niepożądane uniemożliwiające dalsze stosowanie leku. Zanubrutynib jest lekiem stosowanym doustnie 1 lub 2 razy na dobę (zgodnie z preferencjami pacjenta i lekarza), co umożliwia jego stosowanie w warunkach ambulatoryjnych.
Przed rozpoczęciem leczenia musi być zebrany dokładny wywiad o wszystkich przyjmowanych lekach, suplementach diety czy stosowanych ziołach, gdyż część z nich jest metabolizowana w tych samych szlakach co zanubrutynib i może albo istotnie zwiększać albo zmniejszać ekspozycję na lek.
Zanubrutynib, jako inhibitor kinazy Brutona II generacji, jest bardziej selektywny od ibrutynibu (który jest niedostępny w tym wskazaniu w Polsce), stąd opisuje się zdecydowanie mniej działań niepożądanych, w szczególności mniej przypadków migotania przedsionków, zaburzeń czynnościowych ze strony przewodu pokarmowego, wysypek skórnych czy dolegliwości stawowych.
PRAKTYCZNIE O RADIOTERAPII
Pomimo coraz bardziej zaawansowanej techniki zdrowe tkanki nadal mogą zostać podrażnione lub uszkodzone przez promieniowanie.
Najczęstsze dolegliwości w trakcie napromieniania to nudności, gorączka, podrażnienie skóry oraz wypadanie włosów. Jeśli radioterapia dotyczy głowyi szyi, mogą się pojawić problemy z połykaniem oraz suchość w jamie ustnej.
Należy porozmawiać z lekarzem radioterapeutą na temat szczególnych zasad higieny i środków stosowanych do pielęgnacji podrażnionej skóry i błon śluzowych. Promieniowanie może też wpływać na sąsiadujące z naświetlanym guzem narządy.
Leczenie z zastosowaniem chemioterapii oraz radioterapiiw Polsce jest refundowane, jednak leki pomocnicze trzeba kupować w aptece we własnym zakresie.
- Zaleca się używanie środków dla alergików lub onkodermo-kosmetyków do pielęgnacji skóry
- Skórę należy myć ciepłą (nie gorącą) wodą
- 2-3 razy dziennie smarować skórę kremem nawilżającym
- Podrażnione śluzówki jamy ustnej płukać płynem regenerującym
- Przy podrażnieniu błon śluzowych szczególnie niewskazane jest palenie oraz spożywanie potraw pikantnych, pokarmów twardych i chrupkich
Piszący poradnik mają nadzieję, że pomogli Wam odzyskać pogodę ducha i wiarę, że z chłoniakiem indolentnym da się żyć. Żyć na „pełnej petardzie”, z pogodą znosząc niedogodności okresowego leczenia i kontroli choroby do końca życia.
AUTORZY PORADNIKA
Joanna Drozd-Sokołowska
Wojciech Jurczak
Monika Długosz-Danecka
Pełną treść poradnika znajdziesz tutaj:



