DLBCL i INNE CHŁONIAKI AGRESYWNE
Chłoniaki agresywne z dużych komórek B to grupa nowotworów układu chłonnego wywodzące się z dojrzałych, obwodowych limfocytów B. Komórki nowotworowe rozmnażają się w niekontrolowany przez organizm sposób i niestety nie spełniają w nim funkcji właściwych dla zdrowych limfocytów. Ich nadmiar jest niebezpieczny, prowadzi do postępujących, zagrażających życiu objawów i wymaga stosunkowo szybkiego włączenia leczenia.
- WSTĘP
- OBJAWY
- SKĄD WIADOMO, że to na pewno chłoniak agresywny z dużych komórek B
- KLASYFIKACJA CHŁONIAKÓW AGRESYWNYCH B-KOMÓRKOWYCH
- PERSPEKTYWA I ROKOWANIE
- CZYNNIKI RYZYKA czyli co bierzemy pod uwagę w rokowaniu
- BADANIA DIAGNOSTYCZNE i ocena stanu zaawansowania
- LECZENIE chłoniaków agresywnych z dużych komórek B
- GDY JUŻ LECZENIE SIĘ ZAKOŃCZY
WSTĘP
To grupa chorób o zróżnicowanych cechach klinicznych, morfologicznych i genetycznych. Obejmuje szereg podtypów, których jednak wspólną cechą morfologiczną jest przewaga dużych komórek, a kliniczną – stosunkowo krótki, dynamiczny przebieg choroby.
Choroba może początkowo rozwijać się w węzłach chłonnych, które są niewyczuwalne (dla pacjenta czy lekarza) lub naciekać narządy wewnętrzne. Na początku jej przebieg może być skąpobojawowy. Wcześniej zauważamy chorobę, jeśli zaczną powiększać się węzły łatwo wyczuwalne lub gdy wraz z postępem choroby pojawią się tzw. objawy ogólne (gorączki, poty nocne czy utrata masy ciała). Warto wiedzieć, że chłoniaki, które szybko postępują, równie szybko ulegają regresji, a ustąpienia objawów choroby można oczekiwać już po pierwszym cyklu zastosowanego leczenia.
SKĄD WZIĘŁA SIĘ CHOROBA?
Pochodzenie choroby nie jest do końca jasne i nie wiadomo, dlaczego dana osoba zachorowała właśnie na chłoniaka. Nowotwory układu chłonnego rzadko mogą mieć tendencję do wy-stępowania rodzinnego, jednak nie mówimy o dziedziczeniu, a raczej o trudno uchwytnych czynnikach środowiskowych, takich jak zanieczyszczenia środowiska, styl życia itp. Zdarza się to bardzo sporadycznie, dlatego nie ma szczególnej potrzeby planowania profilaktycznych badań u dzieci czy rodzeństwa pacjentów, a tak-że zaniechania planów rodzicielskich.
Wszystkie choroby nowotworowe, w tym chłoniaki, są częstsze u osób z zaburzeniami odporności (wrodzonymi lub nabytymi w przebiegu różnych chorób). Badania wskazują również na większe ryzyko zachorowania u osób zakażonych niektórymi wirusami, np. Epstein-Barr (EBV). Chłoniaki są również częstsze u osób po usunięciu migdałków czy tych z chorobami autoimmunologicznymi, takimi jak np. zespół Sjögrena.
CHŁONIAKI AGRESYWNE MAJĄ RÓŻNE PODTYPY, A NAJLEPSZE SZANSE NA CAŁKOWITE WYLECZENIE DAJE DOBRZE ZAPLANOWANE LECZENIE I LINII
W 5 edycji klasyfikacji chłoniaków agresywnych znacznie zwiększyła się liczba podtypów chłoniaków agresywnych. Chociaż nadal najczęstszy pozostaje chłoniak rozlany z dużych komórek B bliżej nieokreślony DLBCL NOS, wyodrębniono szereg niezależnych rozpoznań, z których część wymaga innego postępowania. To ważne, gdyż najlepsze szanse na wyleczenie daje optymalnie dobrane i konsekwentnie przeprowadzone leczenie I linii. Planowanie leczenia powinno być zawsze ustalone przez specjalistów mających duże doświadczenie w leczeniu chłoniaków, najlepiej w ośrodku mającym dostęp do wszystkich programów terapeutycznych NFZ oraz nowych technologii medycznych finansowanych w ramach badań klinicznych.
Szybkie rozpoznanie chłoniaka ułatwia leczenie. ważne jednak, aby pamiętać, że nawet jeśli chłoniak zostanie wykryty w zaawansowanym stadium klinicznym, nie zamyka to całkowicie drogi do skutecznego leczenia.
Choć początkowo chłoniaki agresywne mogą być skąpoobjawowe, są procesem szybko postępującym, a nieleczone prowadzą ostatecznie do niewydolności wielonarządowej i śmierci. Bagatelizowanie pierwszych objawów i odracza-nie leczenia jest złym pomysłem. Prowadzona diagnostyka powinna być skrupulatna, pozwalająca na dokładne określenie podtypu histopatologicznego i identyfikację wszystkich czynników ryzyka. Czas ma tu znaczenie, stąd zalecamy pełne podporządkowanie temu swoich planów życiowych, przynajmniej do czasu zakończenia diagnostyki.
PIERWSZE OBJAWY oraz objawy rozwoju choroby
POWIĘKSZENIE WĘZŁÓW CHŁONNYCH
Pierwszym sygnałem alarmowym może być znalezienie powiększonych węzłów chłonnych – widocznych w lustrze lub wyczuwalnych dłonią. Pod pachą, w pachwinie, czy na szyi. Chłoniaki to jednak nie jedyna przyczyna powiększania się węzłów chłonnych. Węzły chłonne są struk-turami, których wielkość zwykle nie przekracza paru mm. średnicy, powiększającymi się w reakcji na infekcję czy lokalny stan zapalny (formalnie za powiększony uznajemy węzeł o wymiarach powyżej 10 x 15 mm). Typowym przykładem prawidłowej reakcji odczynowej są np.: węzły chłonne na szyi przy zapaleniu migdałków (anginie), węzły podżuchwowe przy problemach stomatologicznych, węzły potyliczne przy nie-których infekcjach wirusowych, węzły pachowe w odpowiedzi na lokalny stan zapalny (np. wy-wołany zatkaniem przewodów łojowych po stosowaniu antyperspirantów w „sztyfcie”) czy węzły pachwinowe powiększone przy infekcjach układu moczowo-płciowego. Niepokój powinien budzić przede wszystkim powiększony węzeł chłonny bez cech stanu zapalnego (czyli bez zaczerwienienia, tkliwości, ocieplenia czy obrzęku). Konsultacja lekarza I kontaktu jest wskazana w każdym przypadku, gdy węzeł pozostaje powiększony przez okres ponad 2 tygodni, a nawet wcześniej w razie dalszego wzrostu jego wymiarów.
OBJAWY OGÓLNE
Niestety większość takich nieprawidłowych węzłów chłonnych jest wewnątrz klatki piersiowej lub w jamie brzusznej, stąd pomimo szybkiego postępu choroby jej początek może być skąpoobjawowy. Wtedy pierwszym objawem choro-by może być dopiero pojawienie się wspomnianych już tzw. objawów ogólnych związanych z dużą masą guza: poty nocne, gorączki czy spadek masy ciała.
Jeśli choroba nie zostanie wykryta na wczesnym etapie, a powiększające się węzły chłonne są niewyczuwalne palpacyjnie (czyli „pod palcami”), ich masywne zajęcie przez chorobę może prowadzić do jednego z objawów:
1.Powiększenie węzłów chłonnych śródpiersia w klatce piersiowej może powodować duszność (początkowo jedynie przy wysiłku), suchy kaszel czy nawet wystąpienie zespołu żyły głównej górnej. Jest to zespół objawów spowodowanych utrudnieniem odpływu krwi z żyły głównej górnej do prawego przedsionka serca: poszerzenie żył szyjnych, obrzęk głowy/szyi/kończyn górnych, bóle i zawroty głowy, utrudnienie oddychania.
2.Powiększenie węzłów chłonnych jamy brzusznej może powodować ucisk na żyłę główną dolną i w konsekwencji powodować powstanie wodobrzusza i obrzęków kończyn dolnych. Powiększenie węzłów chłonnych w okolicy dróg żółciowych może prowadzić do żółtaczki zastoinowej. W przebiegu choroby może dojść do powiększenia się śledziony.
3. Nacieki chłoniaka w narządach pozalimfatycznych mogą prowadzić do zaburzenia ich funkcji, stąd część chorych może zgłaszać objawy pozornie bez związku z chłoniakiem. Dla przykładu, nacieki ścian przewodu pokarmowego (najczęściej żołądka) mogą powodować ból w nadbrzuszu, zaburzenia czynnościowe ze strony przewodu pokarmowego, krwawienia, a w skrajnych przypadkach objawy niedrożności i zespoły złego wchłaniania.
4. Szczególnie niepokojące są objawy neurologiczne mogące sugerować zajęcie ośrodkowego układu nerwowego (mózgu). OUN może być pierwotną lokalizacją chłoniaka lub – co zdarza się częściej – do jego zajęcia dochodzi w przypadkach o znacznym zaawansowaniu klinicznym choroby lub przy szczególnej lokalizacji nacieków (np. nacieków choroby w przestrzeni zaotrzewnowej, skąd wnikają one do kanału kręgowego, powodując ucisk rdzenia i korzeni nerwowych).
5. Rzadko (w mniej niż 15% przypadków) dochodzi do objawów niewydolności szpiku kostnego związanych z jego nacieczeniem, co może objawiać się niedokrwistością, małopłytkowością, zwiększoną leukocytozą (limfocytozą), rzadziej leukopenią.
Powyższe objawy mogą być również oznaką nawrotu lub oporności choroby na leczenie, dlatego należy lekarza prowadzącego informować, jeżeli którykolwiek z wyżej opisanych objawów pojawi się i nie ustępuje przez kilka dn
SKĄD WIADOMO, że to na pewno chłoniak agresywny z dużych komórek B
Podstawowym i pierwszym badaniem jest pobranie węzła chłonnego lub innej podejrzanej o zmiany nowotworowe tkanki. Dla szybkiej i prawidłowej diagnostyki niezmiernie ważne jest, by pobrać cały węzeł lub przynajmniej reprezentatywny fragment podejrzanej tkanki. Jedynie w wyjątkowych przypadkach wystarcza biopsja cienkoigłowa umożliwiająca pobranie materiału cytologicznego do oceny immunofenotypu metodą cytometrii przepływowej i ewentualnie wykonania dodatkowych badań genetycznych.
Pobrana tkanka zostaje odpowiednio utrwalona i opracowana w pracowni histopatologicznej, gdzie po szeregu badań dodatkowych określa się, czy i jaki nowotwór się w niej znajduje. Ten proces może trwać nawet kilka tygodni.
Choć słysząc o podejrzeniu chłoniaka, chcielibyśmy, aby ostateczna diagnoza padła jak najszybciej, koniecznie należy uzbroić się w cierpliwość. Nawet przy szybkim terminie pobrania materiału do badania, trzeba poczekać na dokładną ocenę histologiczną, a w części przypadków na uzupełnienie klasycznego badania histopatologicznego o badania genetyczne. Możliwe, a nawet prawdopodobne jest, że poddane wycinki będą wstępnie ocenione w ogólnym zakładzie patologii, a następnie ponownie w ośrodku specjalistycznym, zajmującym się diagnostyką chłoniaków.
System nie jest idealny, wydłuża okres do postawienia rozpoznania, a w części przypadków, wręcz wymaga od pacjenta wypożyczenia tzw. „bloczków parafinowych” i przekazania ich prowadzącemu leczenie specjaliście, by mógł zlecić dodatkowe badania. Pobrane wycinki po utrwaleniu są zatopione w parafinie lub żywicy, co umożliwia ich przechowywanie i ewentualny transport w temperaturze pokojowej. Pobrane preparaty są własnością pacjenta, nikt nie ma prawa odmówić ich wydania, choć zwykle wymaga to podpisania się pod odpowiednim dokumentem. O ile patolodzy sami konsultują preparaty w innym laboratorium, zawsze wracają one do miejsca, w którym oceniano je po raz pierwszy. Choć może wydłużać to proces diagnostyki, tylko dokładnie doprecyzowane rozpoznanie umożliwia wybór optymalnego leczenia I linii. Od tego w znacznym stopniu zależy rokowanie. odpowiednio dobrane i przeprowadzone leczenie I linii. A ponieważ mamy wiele możliwości leczenia, każdy z podtypów chłoniaka może mieć odrębny schemat terapii.
BADANIA OKREŚLAJĄCE DOKŁADNY PODTYP CHŁONIAKA
W wyniku badania histopatologicznego potwierdzającego diagnozę zostanie również podana ekspresja antygenów, które pomagają określić z jaką chorobą mamy do czynienia. Komórki chłoniaków agresywnych wykazują ekspresję antygenów CD19, CD20, CD22, CD79a oraz w różnym odsetku – BCL6, BCL2 i CD10 (20-50%), wyjątkowo antygen CD5 ( 10%). Odsetek komórek w których mamy dodatnią reakcję na ki67 koreluje z ilością komórek dzielących się (w typowych przypadkach DLBCL to 40 – 60%, w chłoniakach o wysokim stopniu złośliwości może sięgać 90-100%).
Zalecany panel markerów immunohistochemicznych powinien obejmować również: MYC, IRF4, cyklinę D1 oraz barwienie EBER1 pozwalające na wykrycie EBV. Ważne jest oznaczenie rearanżacji genu MYC metodą FISH, a w przypadku dodatniego wyniku zaleca się również badanie FISH w kierunku BCL2.
Powyżej opisano tylko niektóre z wykonywanych badań, ich interpretacje należy zostawić prowadzącemu leczenie specjaliście. Niemniej, jeżeli otrzymasz wynik, w którym za-miast szczegółów napisano: „obraz może odpowiadać chłoniakowi rozlanemu z dużych komórek B wskazana konsultacja w ośrodku specjalizującym się w leczeniu chłoniaków”, należy – przed udaniem się do ośrodka specjalistycznego – wypożyczyć preparaty (wspomniane wcześniej „bloczki parafinowe”).
Są różne podtypy histologiczne chłoniaków agresywnych. Poniżej znajdziesz listę podtypów chłoniaków agresywnych, z dojrzałych, obwodowych limfocytów B, zgodnie z 5-tą edycją klasyfikacji WHO z 2022 roku. Najczęstsze podtypy podano na początku listy, rzadsze na dole tabeli. Właśnie w ten sposób będą, a przynajmniej powinny być opisane na wyniku badania histopatologicznego. Nazwy podano również po angielsku, gdyż takich właśnie najczęściej używają opisujący wynik patolodzy.
PERSPEKTYWA i ROKOWANIE
Badanie histopatologiczne odpowie na pytanie, jaki chłoniak agresywny został u Ciebie rozpoznany. Poniżej znajdziesz informacje, co oznacza konkretne rozpoznanie – dla najczęstszych podtypów chłoniaków agresywnych z dużych komórek B.
CHŁONIAK ROZLANY Z DUŻYCH KOMÓREK B BLIŻEJ NIEOKREŚLONY • DLBCL NOS
Najczęściej rozpoznawanym chłoniakiem agresywnym jest chłoniak rozla-ny z dużych komórek B bliżej nieokreślony, czyli DLBCL NOS (ang. diffuse large B cell lymphoma non otherwise speciffied). Charakteryzuje się on dość dobrym, jak na rozsianą chorobę nowotworową, rokowaniem. Blisko 70% osób, które zachorują na chłoniaka DLBCL NOS, można wyleczyć całkowicie, większość z nich, po prawidłowo dobranym i konsekwentnie przeprowadzonym leczeniu I linii. Rokowanie chorych na DLBCL z procesem zlokalizowanym, w I i II stadium klinicznym, bez dużej masy guza, z niskim IPI (za chwilę przeczytasz o indeksie IPI więcej), jest jeszcze lepsze, a o wyleczeniu można mówić nawet w 85% przypadków.
Przy procesie uogólnionym, w III/IV stadium zaawansowania klinicznego (dalej znajdziesz więcej) odsetek wyleczonych pacjentów spada do ok. 60%. Ryzyko niepowodzenia leczenia jest jeszcze większe u chorych z wysokim IPI, podtypem ABC, wysoką frakcją podziałową czy posiadających wysoką ekspresję białek C-MYC i BCL2 (co opisano dokładniej w dalszej części tego artykułu).
Rokowanie i leczenie większości z nowych podtypów chłoniaków agresywnych opisanych w 5 edycji klasyfikacji WHO jest podobne jak w przypadku DLBCL NOS. Jednak nie wszystkich. Poniżej je opisujemy.
CHŁONIAK PIERWOTNY ŚRÓDPIERSIA • PMBCL
Chłoniak pierwotny śródpiersia (ang. primary mediastinal B cell lymphoma) to choroba, w której najczęściej cała masa guza, czyli konglomerat powiększonych węzłów chłonnych, znajduje się właśnie w klatce piersiowej. Ze względu na lokalizację pierwsze objawy pojawiają się późno, gdy guz osiąga stosunkowo duże rozmiary (zwykle 7-10, a w niektórych przypadkach nawet ponad 15 cm średnicy). Pacjenci zgłaszają duszność (początkowo jedynie przy wysiłku), kaszel czy nawet wystąpienie zespołu żyły głównej górnej; często obecne są objawy ogólne.
PMBCL najczęściej rozpoznaje się u młodych kobiet. Konieczne jest różnico-wanie z chłoniakiem Hodgkina i chłoniakiem limfoblastycznym. Pobranie wycinków odbywa się na oddziale torakochirurgicznym, najczęściej w trakcie mediastinoskopii, rzadziej – biopsji transbronchialnej. Odpowiednio dobra-ne leczenie I linii pozwala na wyleczenie ponad 70 % chorych.
CHŁONIAKI O WYSOKIM STOPNIU ZŁOŚLIWOŚCI Z KOMÓRK B • HGBCL NOS • HGBCL
Mówimy tu u paru podtypach chłoniaków, często zwyczajowo nazywanych od ich nazw angielskich „high grade”. Najczęstsze to HGBCL NOS (czyli bliżej nieokreślone) i HGBCL z rearanżacją onkogenów C-MYC i BCL2, gdzie za nad-ekspersję białek odpowiadają bezpośrednio zaburzenia cytogenetyczne (dawniej nazwane „double hit”).
Leczenie HGBCL wymaga indywidualizowanego podejścia lekarzy do wyboru schematu leczenia, chorych bez obciążeń internistycznych zwykle próbuje się leczyć intensywniej. Szanse na całkowite wyleczenie są jednak mniejsze i nie przekraczają 50%.
CHŁONIAK BURKITTA • BL
Chłoniak Burkitta (ang. Burkitt`s lymphoma) to chłoniak agresywny o naj-większej dynamice, wymagający bardzo pilnego rozpoczęcia leczenia. Najczęściej objawy narastają szybko, zwykle jest to gwałtownie rosnący guz w jamie brzusznej. Wymaga intensywnego postępowania, długotrwałych, jak na leczenie chłoniaka, hospitalizacji. Niemniej większość pacjentów (90% z tych pacjentów, których uda się bez powikłań poddać zaplanowanemu leczeniu) osiąga remisję, po której chłoniak nie nawraca.
CHŁONIAK OŚRODKOWEGO UKŁADU NERWOWEGO • OUN
Tak nazywamy chłoniaka, który zlokalizowany jest w mózgu. Ośrodkowy układ nerwowy może być jedyną lokalizacją choroby (w nowej klasyfikacji WHO określa się ją wówczas jako chłoniaka miejsc immunologicznie uprzywilejowanych) lub może być zajęty przez inny podtyp chłoniaka w zaawansowanym stadium klinicznym.
Niezależnie jednak od tego, na jakim etapie choroby chłoniak zaatakował ośrodkowy układ nerwowy, rokowanie jest niepewne i wymaga odrębnego postępowania dostosowanego do wieku, stanu czynnościowego pacjenta i jego chorób towarzyszących.
CZYNNIKI RYZYKA czyli co bierzemy pod uwagę w rokowaniu
Wyleczenie DLBCL i innych chłoniaków agresywnych zależy głównie od ich wrażliwości na leczenie i możliwości jego zastosowania u konkretnego pacjenta (wieku i stanu czynnościowego chorego, chorób towarzyszących).
Stosowane przez nas leki, podane doustnie czy dożylnie, działają w całym organizmie, stąd w przeciwieństwie do guzów litych (np. raka żołądka czy raka płuca), gdzie rokowanie zależy od powodzenia zabiegu chirurgicznego, stadium zaawansowania klinicznego jest mniej istotne. U chorych na chłoniaki w ogóle nie mówimy o przerzutach, które mogą determinować rokowanie, ważne jest natomiast uzyskanie całkowitej odpowiedzi na leczenie. Częściowa odpowiedź na leczenie czy stabilizacja procesu (i oczywiście progresja choroby) są wskazaniami do kontynuowania leczenia, z zastosowaniem alternatywnych leków.
Wspomniany już wcześniej IPI (ang. International Prognostic Index), czyli międzynarodowy wskaźnik prognostyczny dla chłoniaka DLBCL i innych chłoniaków agresywnych, pozwala dokładniej szacować ryzyko niepowodzenia leczenia w oparciu o proste, powszechnie dostępne dane kliniczne. Podobną rolę spełnia np. FLIPI u chorych na chłoniaka grudkowego, czy IPI dla HD u chorych na chłoniaka Hodgkina.
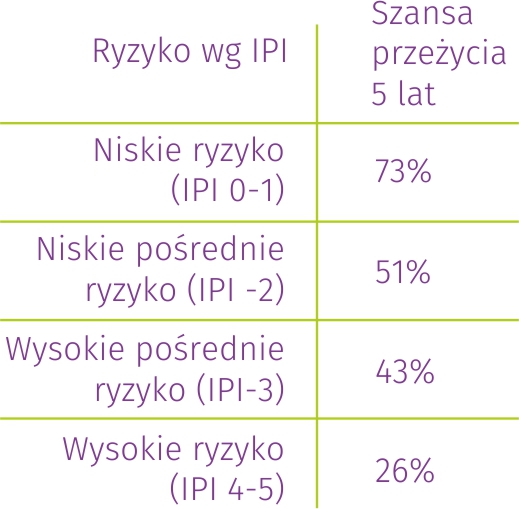
Określając wskaźnik IPI bierze się pod uwagę wiek (>60 r.ż.), stan ogólny chorego (2-4 pk. wg skali ECOG), stadium zaawansowania klinicznego chłoniaka (III i IV stadium), liczbę lokalizacji pozawęzłowych (>1) i aktywność LDH w surowicy (> norma). IPI został opracowany w czasach, gdy wszystkich pacjentów leczono immunochemioterapią R-CHOP, a nowe technologie medyczne nie były jesz-cze dostępne, stąd rokowanie w 2023 roku jest lepsze. Międzynarodowy wskaźnik pro-gnostyczny dobrze jednak odzwierciedla potrzebę, intensyfikacji leczenia już w I linii u wybranych pacjentów.
Na rokowanie DLBCL ma też wpływ ekspresja niektórych białek (np. C-MYC czy BCL2), szczególnie w przypadkach, w których prowadzą do tego współistniejące zaburzenia cytogenetyczne (rearanżacje genów C-MYC i BCL2). W obecnej klasyfikacji chłoniaki DLBCL „double hit” zostały wyodrębnione jako HGBCL. Znaczenie dla rokowania DLBCL ma również pochodzenie komórek, z których wywodzi się klon nowotworowy: lepiej rokujący GCB (ang. germinal center B-cell type, typ wywodzący się z komórek B ośrodków rozmnażania) i non-GCB zwany inaczej ABC (ang. activated B-cell type, typ wywodzący się z aktywowanych komórek B). Rozróżnienie podtypów wymaga badań genetycznych, choć doświadczony hematopatolog może się pośrednio, z dużym prawdopodobieństwem, wypowiadać na ten temat w oparciu o rozszerzone barwienia immunohistochemiczne.
Trzeba jednak pamiętać, że wszystkie rozważania o rokowaniu na podstawie IPI czy innych czynników ryzyka mają charakter statystyczny i mogą nie odnosić się bezpośrednio do indywidualnego chorego, jak również nie biorą pod uwagę zmian w leczeniu i jego skuteczności na przestrzeni zaledwie ostatnich kilku lat. Stąd całkowite wyleczenie może być udziałem pacjenta o bardzo wysokim ryzyku i odwrotnie, niepowodzenie leczenia może się zdarzyć również w grupie o potencjalnie najlepszym rokowaniu.
BADANIA DIAGNOSTYCZNE i ocena stanu zaawansowania
Kiedy już wiadomo, że chorujesz na chłoniaka rozlanego z dużych komórek B lub inny podtyp chłoniaka agresywnego, ważnym kolejnym krokiem jest ocena stanu zaawansowania choroby. Pozwala to prawidłowo dobrać intensywność leczenia i – co równie ważne – monitorować jego skuteczność.
Wstępne informacje mamy po dokładnym badaniu fizykalnym, w którym lekarz ocenia m.in. obwodowe węzły chłonne oraz wstępnie wielkość wątroby i śledziony. Wraz z wywiadem pozwala na ocenę występowania tzw. objawów ogólnych i stanu ogólnego Twojego organizmu.
PET-CT
Standardem, bez którego trudno jest wyobrazić sobie nowoczesne leczenie, jest badanie PET-CT, które jest o wiele bardziej przydatne od standardowej tomografii komputerowej. Badanie PET-CT to technika badania obrazowego łącząca tomografię z badaniem czynnościowym. Dzięki użyciu glukozy znakowanej izotopem uzyskujemy informację, czy w takim powiększonym węźle chłonnym jest widoczna aktywność nowotworu. Wykorzystuje się fakt, że komórki nowotworowe są stosunkowo aktywne, stąd potrzebują więcej glukozy. „Zjadają ją, następnie trawią”, a pozostały w ich wnętrzu izotop wskazuje, gdzie są ich największe skupiska. Im więcej w danej okolicy izotopu, tym silniejszy sygnał i wyższy tzw. SUV (jeden z parametrów opisywanych w badaniu PET-CT). Podobnie dzieje się w przypadku reaktywnego pobudzenia komórek układu immunologicznego, stąd przed badaniem PET-CT należy upewnić się, czy nie mamy aktywnej infekcji.
W chłoniakach agresywnych badanie PET-CT wykonuje się nie tylko na początku – przed chemioterapią, ale także po 2 kursach leczenia (tzw. wczesna ocena odpowiedzi) i po zakończonej terapii. Uzyskaną odpowiedź podaje się w stopniach Deauville, zgodnie z międzynarodowym systemem. Wartości w skali Deauville 1-3 świadczą o zadowalającej odpowiedzi metabolicznej, 4-5 oznacza zwykle jedynie częściową odpowiedź lub wręcz progresję choroby.
Badanie PET CT jest podstawą oceny stopnia zaawansowania klinicznego wg tzw. klasyfikacji z Lugano (modyfikacji wcześniej stosowanej klasyfikacji z Ann Arbor). Na tej podstawie podejmuje się dalsze decyzje terapeutyczne.
We wczesnej ocenie skuteczności leczenia, badanie PET-CT wykonujemy w 2-3 tygodnie po poprzednim cyklu chemioterapii, niemal bezpośrednio przed kolejną dawką cytostatyków. Wyniki tego badania mogą być „fałszywie ujemne”, komórki nowotworowe mogą nie być w pełni aktywne bezpośrednio po leczeniu (zachowują się jak mysz złapana przez kota, która udaje martwą). W pełni wiarygodny wynik badania PET-CT można uzyskać w nie mniej niż w 6 tygodni po podaniu ostatniego cyklu chemioterapii. Przy radioterapii mamy sytuację odwrotną – po leczeniu utrzymuje się stan zapalny, który może dawać początkowo wynik fałszywie dodatni, stąd wiarygodne wyniki są nie wcześniej niż w 3 miesiące po zakończeniu napromienienia.
- Każda infekcja utrudnia lub wręcz uniemożliwia interpretacje badania PET-CT. Na pewno należy przełożyć termin badania, gdy wykonujemy je po zakończeniu terapii, dla potwierdzenia cał-kowitej odpowiedzi na leczenie. U chorych z infekcją wynik PET-CT może być fałszywie dodatni, tzn. błędnie sugerować brak remisji i potrzebę dalszego leczenia. Decyzje o przełożeniu terminu badania są mniej jednoznaczne w pozostałych przypadkach i muszą być podjęte przez lekarza prowadzącego.
- Dla każdego pacjenta zamawia się indywidualnie dawkę izotopu, stąd na skierowaniu podaje się wagę i wzrostu chorego. Jeżeli nie możesz przyjść na badanie lub jego termin został przełożony przez lekarza prowadzącego, pamiętaj, by koniecznie powiadomić o tym pracownię PET-CT. Wiedząc o tym, będzie można wykorzystać zamówiony izotop dla innego chorego i tak ułożyć gra-fik, by umożliwić Ci wcześniejszy termin kolejne-go badania.
- W dniu badania należy bezwzględnie powstrzymać się od zjedzenia czegokolwiek i wypicia płynów zawierających jakiekolwiek kalorie. Tak, by podana glukoza znakowana izotopem była dla komórek nowotworowych pierwszą „dawką kalorii” w tym dniu. Należy natomiast zadbać o dobre nawodnienie (co najmniej 1 -1,5 litra niegazowanej wody wypitej przed badaniem oraz dalszy litr wypity w trakcie badania).
- Jeżeli masz cukrzycę, nietolerancję glukozy lub zażywasz leki przeciwcukrzycowe, koniecznie poinformuj o tym pracownię PET-CT – zostaną wydane Ci szczegółowe instrukcje i optymalnie wybrana godzina badania.
- Nie ma szczególnej diety zalecanej we wcześniejszych dniach, ale z oczywistych względów, jak przy każdym badaniu obrazowym, należy unikać potraw ciężkostrawnych i takich, które mogłyby spowodować powstanie dużej ilości gazów w przewodzie pokarmowym.
- Pacjenci po badaniu PET-CT nie są „radioaktywni”, niebezpieczni dla osób trzecich. Należy jednak pamiętać o konieczności antykoncepcji (również mężczyźni!). W wątpliwych przypadkach na-leży przed badaniem wykonać test ciążowy.
LECZENIE chłoniaków agresywnych z dużych komórek B
W leczeniu chłoniaków agresywnych mają zastosowanie różne schematy immunochemioterapii, celowana chemioterapia, wysokodawkowana chemioterapia, różne postacie immunoterapii (leki immunomodulujące, przeciwciała monoklonalne w tym dwuspecyficzne, terapie komórkowe, takie jak terapie CART czy przeszczep allogeniczny komórek macierzystych) czy w końcu radioterapia.
Jeżeli wszystko układa się po naszej myśli, leczenie I linii trwa ok. 6 miesięcy, wiąże się zwykle z koniecznością hospitalizacji co 2-4 tygodnie. Po zakończeniu leczenia agresywnego chłoniaka kontynuuje się obserwację chorego przez okres 5 lat. Ryzyko wznowy procesu, największe w pierwszym roku od zakończenia leczenia, spada do mniej niż 10% po 2 latach obserwacji.
LECZENIE I LINII
Po zakończeniu diagnostyki i ocenie zaawansowania choroby oraz czynników ryzyka, leczenie powinno być wdrożone jak najwcześniej, a celem terapeutycznym jest uzyskanie całkowitej remisji i wyleczenie.
Chłoniaki które szybko postępują, równie szybko ulegają regresji, znaczącej poprawy można oczekiwać już po pierw-szym cyklu zastosowanego leczenia, a w niektórych przypadkach już po rozpoczęcia tzw. „pretreatmentu”, czyli podaniu sterydów lub małych dawek cytostatyków, co jest możliwe jeszcze przed przyjęciem na oddział. W tym miejscu należy podkreślić, że rozpoczęcie jakiegokolwiek leczenia, w tym podania wspomnianych wyżej sterydów, jest możliwe jedynie po pełnym zakończeniu diagnostyki histopatologicznej i określeniu stadium zaawansowania klinicznego lub ze wskazań życiowych. Brak pełnego rozpoznania, uniemożliwia optymalny wybór leczenia I linii.
Dokładne rozpoznanie podtypu chłoniaka jest ważne, gdyż od tego zależy właściwy wybór leczenia I linii. Schemat immunochemioterapii R-CHOP 21 (rytuksymab, cyklofosfamid, doksorubicyna, winkrystyna i prednizon, powta-rzany co 21 dni), uznany za standard postępowania od ponad 20 lat, pozwala na uzyskanie trwałego wyleczenia u około 60% chorych. W schemacie tym wszystkie leki dożylne podaje się w dniu 1, kontynuując stosowanie doustnych sterydów w dniach 1-5. Pozwala to na podanie cyklu w warunkach krótkiej, 2-dniowej hospitalizacji lub wręcz w dziennym ośrodku leczenia.
Standardem jest podanie 6 cykli R-CHOP – stosowanie dodatkowych 2 cykli (łącznie 8) nie jest obecnie powszechnie rekomendowane. Nie oznacza to jednak, że jest to optymalny wybór dla wszystkich chorych na chłoniaki agresywne.
W tabeli z nazwami podtypów chłoniaków – na fioletowo zaznaczono te, których nie należy leczyć immunochemioterapią R-CHOP, na zielono te, w których można rozważyć alternatywne schematy immunochemioterapii, o czym przeczytasz dalej w tym artykule.
Idąc jednak po kolei:
LECZENIE I LINII CHORYCH z grupy niskiego ryzyka
Pacjenci z chorobą o niskim ryzyku, z IPI 0-1 leczeni immunochemioterapią R-CHOP-21 mają korzystne rokowanie. U pacjentów z chorobą w I – II stadium zaawansowania klinicznego, z niskim IPI, z małą masą guza, z całkowitą odpowiedzią we wczesnej ocenie PET-CT, leczenie można wręcz ograniczyć do czterech cykli R-CHOP-21.
LECZENIE I LINII CHORYCH z grupy pośredniego i wysokiego ryzyka
Wynik leczenia I linii zależy od czynników ryzyka (IPI), zaburzeń cytogenetyczno-molekularnych i pochodzenia komórek, z których wywodzi się klon komórek nowotworowych . Gorsze rokowanie chorych z podtypem non-GCB (ABC) stało się przesłanką do poszukiwania nowych schematów leczenia. Próba dołączenia bortezomibu, ibrutynibu lub lenalidomidu do schematu R-CHOP21 nie przy-niosła jednoznacznych rezultatów, podobnie jak zmiana przeciwciała monoklonalnego rytuksymabu na nowszy obinutuzumab. Oznacza to, że w badaniach wieloośrodkowych III fazy, gdzie duże grupy chorych na DLBCL leczono w sposób „losowy”, porównując skuteczność innych schematów z protokołem R-CHOP, nie wykazano istotnych różnic.
Pierwszym i jak dotąd jednym schematem leczenia, który wykazał większą skuteczność w pierwszej linii u pacjentów z pośrednim i wysokim ryzykiem (IPI 2 -5) jest Pola R-CVP. W schemacie tym dodatkowo zastosowano celowaną chemio-terapię – polatuzumab wedotyny, zastępując nim winkrystynę ze schematu R-CHOP. W istotny sposób zmniejszono ryzyko progresji, nawrotu choroby i zgonu, ustanawiając nowy standard leczenia I linii chłoniaków DLBCL. Amerykańska FDA oraz europejska EMA zatwierdziła polatuzumab wedotyny i schemat Pola-RCHP jest stosowany u chorych na chłoniaka DLBCL o pośrednim i wysokim ryzyku wg IPI i jest od stycznia 2024 refundowany w Polsce również w pierwszej linii leczenia.
Wyniki badań II fazy czy retrospektywnych analiz podgrup chorych mają mniejsze znaczenie i nie można uznać na ich podstawie alternatywnego schematu leczenia za powszechnie uznany standard. W pewnych sytuacjach klinicznych, u pacjentów z grupy wysokiego ryzyka można ewentualnie rozważać R-CHOP powtarzany co 14 dni, R-CHOEP (gdzie dodatkowym lekiem jest etopozyd) czy R-DAEPOCH (schemat, gdzie cytostatyki podaje się w długich wlewach dożylnych, zwiększając w kolejnych cyklach ich dawkę do granic tolerancji organizmu chorego).
LECZENIE I LINII CHORYCH STARSZYCH, z wieloma chorobami towarzyszącymi
Niezależnie od wieku, należy u każdego przed rozpoczęciem leczenia dokonać oceny układu krążenia (konsultacja kardiologiczna, badanie echokardiograficzne z oceną frakcji wyrzutowej). U chorych z niewydolnością serca należy rozważyć zastąpienie doksorubicyny przez jej mniej toksyczną postać liposomalną lub wręcz zmianę schematu chemioterapii na alternatywny (np. mini R-CHOP lub bendamustynę z rytuksymabem). Skuteczność tych schematów jest jednak mniejsza. Alternatywą może być również udział w badaniach klinicznych, np. z celowaną chemioterapią czy przeciwciałami bispecyficznymi.
WCZESNA OCENA SKUTECZNOŚCI PO 2 CYKLU IMMUNOCHEMIOTERAPII
Coraz więcej ośrodków uznaje za standard tzw. „wczesną ocenę skuteczności leczenia” w bada-niu PET-CT, po 2-gim cyklu immunochemioterapii. Pozwala to na optymalny dobór dalszego postępowania, w tym zmianę schematu leczenia w razie jego nieskuteczności.
OCENA KOŃCOWA
Wyniki leczenia oceniamy ostatecznie w badaniu PET-CT po zakończeniu immunochemioterapii. Jedynym w pełni satysfakcjonującym wynikiem jest całkowita odpowiedź metaboliczna w badaniu PET-CT, w skali Deauville 1-3. Ocenia się również regresję morfologiczną (czyli wymiary zmian) – jednak tu dopuszcza się możliwość blizny (czyli skupiska tkanki łącznej) w miejscu wcześniejszych nacieków chłoniaka. Brak adekwatnej regresji morfologicznej może wymagać dalszej obserwacji, w tym wcześniejszego, kontrolnego badania PET-CT, stąd zawsze zapytaj o to lekarza prowadzącego leczenie.
CHOROBA OPORNA/NAWROTOWA LECZENIE II LINII
LECZENIE III i DALSZYCH LINII
Każdy schemat leczenia opisany w II linii można również rekomendować w III i dalszych liniach leczenia, jednak standardem, który powinno się rozważać u wszystkich chorych jest terapia CAR-T (chimeric antygen receptor T cells).
CAR-T
CAR-T to terapia komórkowa z wykorzystaniem zmodyfikowanych w laboratorium własnych limfocytów T chorego, „uzbrojonych” do walki z komórkami nowotworowymi. Ich podanie drogą dożylną można porównać do dostarczenia do organizmu „legionu zabójców” przeszkolonych w niszczeniu komórek nowotworowych. Należy tu pod-kreślić wielokrotnie większą skuteczność od wysokodawkowanej chemioterapii wspomaganej przeszczepieniem komórek macierzystych (ASCT) i znacznie większe bezpieczeństwo leczenia od przeszczepu allogenicznego. Terapia CAR-T daje szansę na odpowiedź u 60% chorych, wliczając w to pacjentów z pierwotną opornością i wczesną wznową. Terapia CAR-T została zatwierdzona przez Europejską Agencję Leków (EMA) oraz Amerykańską Agencję ds. Żywności i Leków (FDA) również u pacjentów wysokiego ryzyka już w II linii leczenia, jednak w Polsce jest refundowana w ra-mach NFZ jedynie u chorych ze wznową lub opornością po II liniach leczenia.
Najczęstsze efekty działań niepożądanych terapii CAR-T (tzw. zespół uwalniani acytokin i neurotoksyczność) są ograniczone do okresu paru tygodni po procedurze, której śmiertelność nie przekracza 5%. Szanse na skuteczne wyleczenie choroby maleją z każdym kolejnym nawrotem choroby, dlatego dążymy do jak najwcześniejszego zastosowania terapii CAR-T w pierwszych nawrotach choroby.
Więcej o CAR-T znajdziesz tutaj
PRZECIWCIAŁA DWUSPECYFICZNE
Ze wspomnianych już wcześniej, przy opisie leczenia II linii, badań klinicznych warto podkreślić te, w których wykorzystuje się przeciwciała dwuspecyficzne. Mogą one stać się alternatywą dla terapii CAR-T i są najlepszą opcją u chorych wznawiających po terapii CAR-T. Przeciwciała dwuspecyficzne łączą komórki nowotworowe z krążącymi w naszym organizmie limfocytami, ułatwiając im ich rozpoznanie. To tak, jakby policjantowi, którego zadaniem jest aresztowanie obecnych w tłumie ludzi przestępców, dać narzędzie, dzięki któremu mógłby ich bez trudu rozpoznać.
ALLOPRZESZCZEP
Allogeniczne przeszczepienie komórek macierzystych(allo-SCT), od dawcy rodzinnego lub nie-spokrewnionego, ma ograniczone zastosowanie w leczeniu chłoniaków agresywnych i może być proponowanym leczeniem w rzadkich przypadkach kolejnych nawrotów po autoHSCT lub CAR-T lub braku możliwości ich przeprowadzenia.
Allo-SCT wymaga czasu, by przeszczepiony układ immunologiczny nauczył się rozpoznawać i za-bijać komórki nowotworowe. O ile w przypadku terapii CAR-T podajemy „legion wyszkolonych już zabójców” to w przypadku allo-SCT podaje się „rekrutów”, którzy staną się wojskiem dopiero po odbyciu szkolenia. Stąd konieczność efektywnego zmniejszenia masy guza przed przeszczepem allogenicznym, tak by w najbliższych miesiącach po procedurze zapobiec niekontrolowanej progresji choroby, co nie zawsze jest możliwe.
LECZENIE PALIATYWNE
W III i dalszych liniach leczenia, można prowadzić również leczenia paliatywne, które choć nie daje szans na „wyrwanie choroby z korzeniami”, po-zwala na wydłużenie życia. Postępowanie to zwykle oznacza podawanie częściej, mniejszych dawek cytostatyków, sterydów czy lokalnej radioterapii.
BADANIA KLINICZNE
W ostatnich latach pojawia się wiele nowych leków, które są poddawane szeregowi badań klinicznych. Szpitale w Polsce również w nich uczestniczą, dlatego możesz otrzymać propozycję udziału w badaniu klinicznym. Próby kliniczne są poprzedzone wieloletnią pracą w laboratorium. Wprowadzane substancje zostały już ocenione pod kątem bezpieczeństwa dla ludzi. Badania podlegają ścisłemu nadzorowi zarówno ze strony lekarza stosującego dane leczenie (badacza), firmy wprowadzającej nowy lek jak i przez organy państwowe (Urząd Rejestracji Produktów Leczniczych). Podobnie jak przy standardowym leczeniu mogą pojawić się powikłania i efekty niepożądane. Masz prawo do rezygnacji z uczestnictwa w badaniu na każdym etapie jego trwania. Nie ponosisz wówczas żadnych negatywnych konsekwencji, a lekarz wdraża ponownie standardową terapię.
Podsumowując – badania kliniczne są korzystne, dają bowiem możliwość stosowania nowych i potencjalnie skutecznych, a często bardzo drogich i niedostępnych w inny sposób, leków.
SYTUACJE SZCZEGÓLNE
W poprzednich wersjach klasyfikacji WHO dopuszczano możliwość wyodrębnienia nowego podtypu chłoniaka jedynie w sytuacji, gdy można go było w powtarzalny sposób rozpoznać w pracowni histopatologicznej przy pomocy rutynowo stosowanych metod oraz gdy istniały różnice w leczeniu.
W 5 edycji klasyfikacji WHO pojawił się szereg nowych jednostek chłoniaków agresywnych, w tym część o specyficznych zaburzeniach cytogenetycznych stwarzających potencjalny punkt uchwytu działania nowych leków. Ma to większe znaczenie dla badań klinicznych niż dla obowiązującego standardu leczenia. W tabeli na stronach 15 i 16 zdecydowaliśmy się podać kompletną listę podtypów chłoniaka DLBCL, które możesz znaleźć na wyniku badania histopatologicznego, ale tylko w niektórych sytuacjach oznacza to odrębne postępowanie.
CHŁONIAK PIERWOTNY ŚRÓDPIERSIA
(Primary mediastinal large B cell lymphoma, PMBCL)
PMBCL najczęściej rozpoznawany u młodych kobiet, charakteryzujący się pierwotnym zajęciem węzłów chłonnych w śródpiersiu, ma lepsze rokowanie od innych podtypów, ale jedynie pod warunkiem zastosowania intensywniejszych schematów leczenia. Większość z ośrodków stosuje R-CHOP 14 lub R-DAEPOCH.
Co ważne, w przypadku oporności na „standardową” dla DLBCL chemioterapię R-CHOP – 21, rzadko udaje się uzyskać trwałą odpowiedź na leczenie II i dalszych linii. W części przypadków (u pacjentów z częściową odpowiedzią na leczenie I linii) rekomenduje się radioterapię lub konsolidację z ASCT. Po-minięcie radioterapii jest możliwe głównie u chorych z całkowitą odpowiedzią na schemat R-DAEPOCH.
Nawrót choroby może być oporny na chemioterapię, a wyniki leczenia w takich przypadkach są niepewne. W chłoniakach PMBCL obserwuje się liczne charakterystyczne zmiany molekularne, które mogą kwalifikować się do leczenia nowymi terapiami. W czerwcu 2018 roku Amerykańska Agencja ds. Żywności i Leków (FDA) za-twierdziła u chorych ze wznową/opornym na leczenie PMBCL pembrolizumab (inhibitor punktu kontrolnego; humanizowane przeciwciało mono-klonalne wiążące się z PD-1, przez co dochodzi do „odblokowania” naszego układu immunologicznego, pozwalając na pełne wykorzystanie jego aktywności). Lek ten nie jest w 2023 roku refundowany w tym wskazaniu w ramach NFZ, który dopuszcza jego stosowanie w innych chorobach nowotworowych.
Od III linii leczenia jest refundowana terapia CAR-T, co w rzeczywisty sposób zmienia rokowanie chorych.
CHŁONIAK PLAZMOBLASTYCZNY
(Plasmoblastic lymphoma)
To stosunkowo rzadki podtyp chłoniaka agresywnego, o niepewnym rokowaniu. Nie mam on na powierzchni komórek nowotworowych anty-genu CD20, stąd nie stosuje się w jego leczeniu rytuksymabu ani innych przeciwciał anty-CD2.
CHŁONIAKI WYSOCE AGRESYWNE Z KOMÓREK B
(High grade B-cell lymphoma, HGBCL)
Tak nazywamy chłoniaki o wysokiej frakcji proliferacyjnej, charakterystycznym obrazie histopatologicznym lub obecnością rearanżacji C-MYC i BCL2 czy innych onkogenów. W 5 edycji klasyfikacji WHO to kilka niezależnych jednostek, z któ-rych wszystkie charakteryzuje duża dynamika choroby i gorsza odpowiedź na standardową immunochemioterapię R-CHOP. Podkreśla to tylko znaczenie skrupulatnego rozpoznania, które w przypadkach podejrzenia chłoniaka o wysokim stopniu złośliwości („high grade”) powinno być uzupełnione o badania rearanżacji metodą FISH.
Obecnie nie określono optymalnego standardu leczenia dla chorych na HGBCL. Schemat R-CHOP rekomenduje się wyłącznie w przypadku choroby ograniczonej, natomiast nie jest leczeniem o wy-starczającej intensywności w zaawansowanych chłoniakach wysoceagresywnych. Najczęściej stosuje się schemat DA-EPOCH-R, R-hyper-CVAD lub R-CODOX-M/R-IVAC. Dane o ich skuteczności pochodzą głównie z badań retrospektywnych, u części chorych leczenie konsolidowano ASCT.
U wszystkich chorych z HGBCL wskazana jest profilaktyka zajęcia OUN.
W przypadku chorych opornych/nawrotowych, podobnie jak u chorych z DLBCL NOS, opcję terapeutyczną stanowi terapia CAR-T, przeciwciała dwuspecyficzne oraz chemioterapia oparta na pochodnych platyny z konsolidacją ASCT.
GDY JUŻ LECZENIE SIĘ ZAKOŃCZY
- po zakończeniu leczenia,
- następnie z pierwszym wynikiem badania PET CT (wykonanym optymalnie w 6 tygodni po ostatniej dawce chemioterapii i 3 miesiące po zakończeniu radioterapii),
- później – częstość wizyt może różnić się w indywidualnych przypadkach: jeżeli lekarz prowadzący ma dobry kontakt z chorym, ma pewność, że pacjent zgłosi się do ambulatorium w razie pojawienia się pierwszych niepokojących objawów, następna kontrola wyznaczona „z urzędu” może być w rok po zakończeniu leczenia. W innych przypadkach proponuje się kontrolę począt-kowo co 3 miesiące, po upływie dwóch lat co 6 miesięcy i rzadziej.
Choć rutynowo obserwacje chorych po leczeniu chłoniaka agresywnego prowadzi się przez 5 lat, w praktyce do wznowy może dojść w pierwszym, rzadziej w 2-gim roku po zakończeniu leczenia.
AUTORZY PORADNIKA
Monika Długosz-Danecka
Wojciech Jurczak
Ewa Pietrusza
Pełną treść poradnika znajdziesz tutaj:



